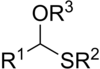

В сероорганической химии тиоацетали являются серными ( тио- ) аналогами ацеталей ( R −CH(−OR) 2 ). Существует два класса : менее распространенные монотиоацетали с формулой R−CH(−OR')−SR" и дитиоацетали с формулой R−CH(−SR') 2 (симметричные дитиоацетали) или R−CH(−SR')−SR" (асимметричные дитиоацетали). [1]
Симметричные дитиоацетали относительно распространены. Их получают конденсацией тиолов ( −SH ) или дитиолов (две группы −SH ) с альдегидами ( −CH=O ). Эти реакции протекают через промежуточное образование гемитиоацеталей ( R −CH(−OH ) −SR' ):
В таких реакциях в качестве катализатора обычно используется кислота Льюиса или кислота Бренстеда .
Дитиоацетали, полученные из альдегидов и 1,2-этандитиола или 1,3-пропандитиола, особенно распространены среди этого класса молекул для использования в органическом синтезе . [2]
Карбонильный углерод альдегида является электрофильным и поэтому подвержен атаке нуклеофилов , тогда как аналогичный центральный углерод дитиоацеталя не является электрофильным. В результате дитиоацетали могут служить защитными группами для альдегидов.
Этот углерод далеко не нереакционноспособен и в реакции, отличной от реакции альдегидов, его можно депротонировать , сделав нуклеофильным:
Инверсия полярности между R'(H)C δ+ =O δ− и R'CLi(SR) 2 называется умполунгом . Реакция обычно проводится с использованием 1,3-дитиана . Литированный промежуточный продукт может быть использован для различных реакций образования нуклеофильных связей, а затем дитиокеталь гидролизуется обратно в свою карбонильную форму. Этот общий процесс, реакция Кори–Зеебаха , дает синтетический эквивалент ацильного аниона.