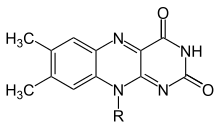

Флавины (от латинского flavus , «желтый») обычно относятся к классу органических соединений , содержащих трициклический гетероцикл изоаллоксазин или его изомер аллоксазин и его производные. Биохимическим источником флавина является желтый витамин В рибофлавин . Флавиновая часть часто присоединяется с аденозиндифосфатом с образованием флавинадениндинуклеотида ( FAD ), а в других обстоятельствах обнаруживается как флавинмононуклеотид (или FMN ), фосфорилированная форма рибофлавина . Именно в той или иной из этих форм флавин присутствует в качестве простетической группы во флавопротеинах . Несмотря на схожие названия, флавины (с «i») химически и биологически отличаются от флавоноидов ( с «а») и флавонолов (с «о»).
Флавиновая группа способна вступать в окислительно-восстановительные реакции и может принимать либо один электрон в двухстадийном процессе, либо два электрона одновременно. Восстановление осуществляется путем присоединения атомов водорода к определенным атомам азота в кольцевой системе изоаллоксазина :

В водном растворе флавины при окислении окрашиваются в желтый цвет, приобретая красный цвет в полувосстановленном анионном состоянии или синий в нейтральном ( семихиноновом ) состоянии, и бесцветные при полном восстановлении. [1] Окисленная и восстановленная формы находятся в быстром равновесии с семихиноновой ( радикальной ) формой, сдвинутой против образования радикала: [2]
где Fl ox — окисленный флавин, Fl red H 2 — восстановленный флавин (при присоединении двух атомов водорода) и FlH • семихиноновая форма (присоединение одного атома водорода).
В форме FADH 2 он является одним из кофакторов, которые могут переносить электроны в цепь переноса электронов .
Как свободные, так и связанные с белком флавины фотовосстанавливаются , то есть способны восстанавливаться под действием света по механизму, опосредованному несколькими органическими соединениями, такими как некоторые аминокислоты , карбоновые кислоты и амины . [2] Это свойство флавинов используется различными светочувствительными белками. Например, домен LOV, обнаруженный у многих видов растений, грибов и бактерий, претерпевает обратимые светозависимые структурные изменения, которые включают образование связи между остатком цистеина в его пептидной последовательности и связанным FMN. [3]

Флавинадениндинуклеотид представляет собой группу, связанную со многими ферментами, включая ферредоксин-НАДФ+ редуктазу , моноаминоксидазу , оксидазу D-аминокислот , глюкозоксидазу , ксантиноксидазу и ацил-КоА-дегидрогеназу .
ФАДГ и ФАДГ 2 представляют собой восстановленные формы ФАД. FADH 2 вырабатывается как простетическая группа в сукцинатдегидрогеназе , ферменте, участвующем в цикле лимонной кислоты . При окислительном фосфорилировании две молекулы ФАДН 2 обычно дают 1,5 АТФ каждая или три АТФ вместе взятые.
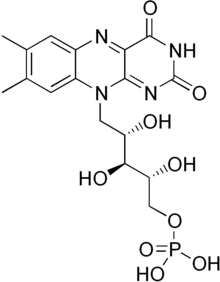
Флавинмононуклеотид представляет собой простетическую группу , обнаруженную, среди других белков, в НАДН-дегидрогеназе , нитроредуктазе E.coli и старом желтом ферменте .