
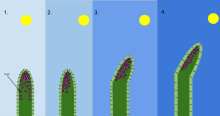
В биологии фототропизм — это рост организма в ответ на световой раздражитель . Фототропизм чаще всего наблюдается у растений , но может встречаться и у других организмов, например, у грибов . Клетки растения, находящиеся дальше всего от света, содержат гормон ауксин , который реагирует на фототропизм. Это приводит к тому, что растение имеет удлиненные клетки на самой дальней от света стороне. Фототропизм — один из многих тропизмов растений или движений, которые реагируют на внешние раздражители. Рост по направлению к источнику света называется положительным фототропизмом , а рост вдали от света — отрицательным фототропизмом . Отрицательный фототропизм не следует путать со скототропизмом, который определяется как рост в сторону темноты, тогда как отрицательный фототропизм может относиться либо к росту вдали от источника света, либо в сторону темноты. [1] Большинство побегов растений проявляют положительный фототропизм и перестраивают свои хлоропласты в листьях, чтобы максимизировать фотосинтетическую энергию и способствовать росту. [2] [3] Кончики некоторых побегов виноградной лозы обладают отрицательным фототропизмом, что позволяет им расти к темным твердым объектам и карабкаться по ним. Сочетание фототропизма и гравитропизма позволяет растениям расти в правильном направлении. [4]
Существует несколько сигнальных молекул , которые помогают растению определить, откуда исходит источник света, и они активируют несколько генов, которые изменяют градиенты гормонов, позволяя растению расти в направлении света. Самый кончик растения известен как колеоптиль , который необходим для восприятия света. [2] Средняя часть колеоптиля — это область, где происходит искривление побега. Гипотеза Холодного-Вента , разработанная в начале 20 века, предсказывает, что в присутствии асимметричного света ауксин будет двигаться в сторону затененной стороны и способствовать удлинению клеток на этой стороне, заставляя растение изгибаться в сторону источника света. [5] Ауксины активируют протонные насосы, снижая pH в клетках на темной стороне растения. Это подкисление области клеточной стенки активирует ферменты, известные как экспансины , которые разрушают водородные связи в структуре клеточной стенки, делая клеточные стенки менее жесткими. Кроме того, повышенная активность протонного насоса приводит к попаданию большего количества растворенных веществ в растительные клетки на темной стороне растения, что увеличивает осмотический градиент между симпластом и апопластом этих растительных клеток. [6] Затем вода поступает в клетки по осмотическому градиенту, что приводит к увеличению тургорного давления. Снижение прочности клеточной стенки и повышение тургорного давления выше порога текучести [7] вызывают набухание клеток, оказывая механическое давление, которое запускает фототропное движение.
Было обнаружено , что белки, кодируемые второй группой генов, генами PIN , играют важную роль в фототропизме. Они являются переносчиками ауксина и считается, что они ответственны за поляризацию местоположения ауксина. В частности , PIN3 был идентифицирован как основной переносчик ауксина. [8] Возможно, что фототропины получают свет и ингибируют активность PINOID киназы (PID), что затем способствует активности PIN3 . Эта активация PIN3 приводит к асимметричному распределению ауксина, что затем приводит к асимметричному удлинению клеток стебля. Мутанты pin3 имели более короткие гипокотили и корни, чем дикий тип, и тот же фенотип наблюдался у растений, выращенных с ингибиторами оттока ауксина. [9] Используя маркировку иммунозолотом против PIN3, наблюдалось перемещение белка PIN3. PIN3 обычно локализуется на поверхности гипокотиля и стебля, но также интернализуется в присутствии брефельдина А (BFA), ингибитора экзоцитоза. Этот механизм позволяет перемещать PIN3 в ответ на раздражитель окружающей среды. Считалось, что белки PIN3 и PIN7 играют роль в импульсно-индуцированном фототропизме. Реакция кривизны у мутанта «pin3» была значительно снижена, но лишь слегка снижена у мутантов «pin7». Между «PIN1», «PIN3» и «PIN7» есть некоторая избыточность, но считается, что PIN3 играет большую роль в импульсно-индуцированном фототропизме. [10]
Есть фототропины, которые высоко экспрессируются в верхней части колеоптилей. Существует два основных фототропизма: фото1 и фото2. Одиночные мутанты phot2 обладают фототропными реакциями, такими же, как у дикого типа, но двойные мутанты phot1 и phot2 не проявляют никаких фототропных реакций. [4] Количество присутствующих PHOT1 и PHOT2 различается в зависимости от возраста растения и интенсивности света. В зрелых листьях арабидопсиса присутствует большое количество PHOT2 , и это также наблюдалось у ортологов риса. Экспрессия PHOT1 и PHOT2 меняется в зависимости от присутствия синего или красного света. В присутствии света наблюдалось снижение уровня мРНК PHOT1 , но усиление транскрипта PHOT2. Уровни мРНК и белка, присутствующие в растении, зависели от возраста растения. Это говорит о том, что уровни экспрессии фототропина меняются по мере созревания листьев. [11] Зрелые листья содержат хлоропласты, которые необходимы для фотосинтеза. Перегруппировка хлоропластов происходит в разной освещенности для максимизации фотосинтеза. Существует несколько генов, участвующих в фототропизме растений, включая гены NPH1 и NPL1 . Оба они участвуют в перестройке хлоропластов. [3] Было обнаружено, что двойные мутанты nph1 и npl1 имеют сниженные фототропные реакции. Фактически, оба гена являются избыточными в определении кривизны стебля.
Недавние исследования показали, что несколько киназ AGC, за исключением PHOT1 и PHOT2, участвуют в фототропизме растений. Во-первых, PINOID, демонстрируя паттерн индуцируемой светом экспрессии, определяет субклеточное перемещение PIN3 во время фототропных реакций посредством прямого фосфорилирования. Во-вторых, D6PK и его гомологи D6PKL модулируют транспортную активность ауксина PIN3, вероятно, также посредством фосфорилирования. В-третьих, выше D6PK/D6PKLs PDK1.1 и PDK1.2 действуют как важные активаторы этих киназ AGC. Интересно, что разные киназы AGC могут участвовать в разных стадиях развития фототропного ответа. D6PK/D6PKL проявляют способность фосфорилировать больше фосфозитов, чем PINOID.
В 2012 году Сакаи и Хага [12] описали, как на затененной и освещенной стороне стебля могут возникать разные концентрации ауксина , вызывая фототропную реакцию. Было предложено пять моделей фототропизма стебля с использованием Arabidopsis thaliana в качестве исследуемого растения.
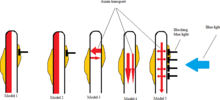
В первой модели входящий свет дезактивирует ауксин на светлой стороне растения, позволяя затененной части продолжать расти и в конечном итоге наклонить растение к свету. [12]
Во второй модели свет ингибирует биосинтез ауксина на светлой стороне растения, тем самым снижая концентрацию ауксина по сравнению с незатронутой стороной. [12]
В третьей модели имеется горизонтальный поток ауксина как со светлой, так и с темной стороны растения. Поступающий свет заставляет больше ауксина перетекать с открытой стороны на затененную сторону, увеличивая концентрацию ауксина на затененной стороне и, таким образом, происходит больший рост. [12]
В четвертой модели показано, как растение получает свет для ингибирования базипетальной ауксина до открытой стороны, в результате чего ауксин стекает только вниз по затененной стороне. [12]
Модель пять включает в себя элементы модели 3 и 4. Основной поток ауксина в этой модели идет от верхушки растения вертикально вниз к основанию растения, при этом некоторая часть ауксина движется горизонтально от основного потока ауксина к обеим сторонам растения. растение. Прием света подавляет горизонтальный поток ауксина от основного вертикального потока ауксина к облучаемой стороне. И согласно исследованию Сакаи и Хаги, наблюдаемое асимметричное распределение ауксина и последующая фототропная реакция в гипокотилях, по-видимому, наиболее соответствуют этому пятому сценарию. [12]
Фототропизм у растений, таких как Arabidopsis thaliana, управляется рецепторами синего света, называемыми фототропинами . [13] Другие светочувствительные рецепторы растений включают фитохромы , воспринимающие красный свет [14] , и криптохромы , воспринимающие синий свет. [15] Различные органы растения могут проявлять разные фототропные реакции на свет разной длины волны. Кончики стеблей проявляют положительную фототропную реакцию на синий свет, а кончики корней - отрицательную фототропную реакцию на синий свет. Как кончики корней, так и большинство кончиков стеблей обладают положительным фототропизмом к красному свету. [ нужна цитация ] Криптохромы — это фоторецепторы, которые поглощают синий/УФ-А свет и помогают контролировать циркадный ритм растений и время цветения. Фитохромы — это фоторецепторы, которые воспринимают красный/дальний красный свет, но они также поглощают синий свет; они могут, среди прочего, контролировать цветение взрослых растений и прорастание семян. Сочетание реакций фитохромов и криптохромов позволяет растению реагировать на различные виды света. [16] Вместе фитохромы и криптохромы ингибируют гравитропизм в гипокотилях и способствуют фототропизму. [2]