Модельный липидный бислой представляет собой любой бислой, собранный in vitro , в отличие от бислоя естественных клеточных мембран или покрытия различных субклеточных структур, таких как ядро . Они используются для изучения фундаментальных свойств биологических мембран в упрощенной и хорошо контролируемой среде, а также все чаще в восходящей синтетической биологии для создания искусственных клеток . [1] Модель бислоя может быть изготовлена как из синтетических, так и из натуральных липидов . Простейшие модельные системы содержат только один чистый синтетический липид. Более физиологически релевантные модельные бислои можно создать из смесей нескольких синтетических или природных липидов.
Существует множество различных типов модельных бислоев, каждый из которых имеет экспериментальные преимущества и недостатки. Первой разработанной системой была черная липидная мембрана или «окрашенный» бислой, которая позволяет легко определять электрические характеристики бислоев, но недолговечна и с ней может быть трудно работать. Поддерживаемые бислои прикреплены к твердой подложке, что повышает стабильность и позволяет использовать инструменты определения характеристик, которые невозможно использовать в объемном растворе. Эти преимущества достигаются за счет нежелательных взаимодействий с субстратами, которые могут денатурировать мембранные белки .
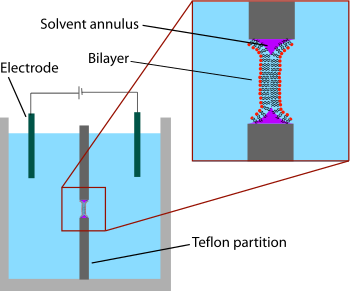
Самой ранней моделью двухслойной системы был «окрашенный» бислой, также известный как «черная липидная мембрана». Термин «окрашенный» относится к процессу изготовления этих бислоев. Сначала в тонком слое гидрофобного материала, такого как тефлон , создается небольшое отверстие . Обычно диаметр этого отверстия составляет от нескольких десятков до сотен микрометров. Для формирования БЛМ область вокруг отверстия сначала «предварительно окрашивают» раствором липидов, растворенных в гидрофобном растворителе , нанося этот раствор поперек отверстия кистью, шприцем или стеклянным аппликатором. [2] Используемый растворитель должен иметь очень высокий коэффициент распределения и быть относительно вязким, чтобы предотвратить немедленный разрыв. Наиболее распространенным растворителем является смесь декана и сквалена .
После высыхания отверстия в обе стороны камеры добавляют раствор соли (водную фазу). Затем отверстие «окрашивается» липидным раствором (обычно тем же раствором, который использовался для предварительного окрашивания). Липидный монослой самопроизвольно образуется на границе раздела органической и водной фаз по обе стороны от капли липид/растворитель. Поскольку стенки отверстия гидрофобны, раствор липид/растворитель смачивает эту границу раздела, утончая каплю в центре. Как только две стороны капли подходят достаточно близко друг к другу, липидные монослои сливаются, быстро исключая небольшой оставшийся объем раствора. В этот момент в центре отверстия образуется бислой, но по периметру остается значительное кольцо растворителя. Это кольцо необходимо для поддержания стабильности, действуя как мост между бислоем ~ 5 нм и листом толщиной в десятки микрометров, в котором сделано отверстие. [3]
Термин «черный» бислой относится к тому факту, что они темны в отраженном свете, поскольку толщина мембраны составляет всего несколько нанометров, поэтому свет, отражающийся от задней поверхности, деструктивно мешает свету, отражающемуся от передней поверхности. Действительно, это был один из первых ключей к тому, что этот метод позволяет получить мембрану толщиной молекулярного масштаба. [4] Черные липидные мембраны также хорошо подходят для определения электрических характеристик, поскольку обе камеры, разделенные бислоем, доступны, что позволяет легко размещать большие электроды. По этой причине электрическая характеристика является одним из наиболее важных методов, используемых в сочетании с окрашенными липидными бислоями. Простые измерения показывают, когда образуется бислой, а когда он разрушается, поскольку неповрежденный бислой имеет большое сопротивление (> ГОм) и большую емкость (~ 2 мкФ/см 2 ). Более продвинутые электрические характеристики были особенно важны при изучении потенциалзависимых ионных каналов . Мембранные белки, такие как ионные каналы, обычно не могут быть включены непосредственно в окрашенный бислой во время формирования, поскольку погружение в органический растворитель приведет к денатурации белка. Вместо этого белок растворяют с помощью детергента и добавляют в водный раствор после образования бислоя. Покрытие из детергента позволяет этим белкам спонтанно внедряться в бислой в течение нескольких минут. Кроме того, проведены первоначальные эксперименты, сочетающие электрофизиологические и структурные исследования черных липидных мембран. [5] В другом варианте техники BLM, называемом двухслойным перфоратором, стеклянная пипетка (внутренний диаметр ~ 10-40 мкм) используется в качестве электрода на одной стороне бислоя, чтобы изолировать небольшой участок мембраны. [6] [7] Эта модификация метода патч-зажима обеспечивает запись с низким уровнем шума даже при высоких потенциалах (до 600 мВ) за счет дополнительного времени на подготовку.
Основными проблемами, связанными с окрашенными бислоями, являются остатки растворителя и ограниченный срок службы. Некоторые исследователи полагают, что карманы растворителя, попавшие между двумя двухслойными листками, могут нарушить нормальную функцию белка. Чтобы преодолеть это ограничение, Монтал и Мюллер разработали модифицированную технику осаждения, которая исключает использование тяжелого нелетучего растворителя. В этом методе отверстие начинается над поверхностью воды, полностью разделяя две камеры с жидкостью. На поверхности каждой камеры монослой формируется путем нанесения липидов в летучий растворитель, такой как хлороформ , и ожидания испарения растворителя. Затем отверстие опускается через границу раздела воздух-вода, и два монослоя из отдельных камер складываются друг против друга, образуя бислой поперек отверстия. [8] Проблему стабильности оказалось решить труднее. Обычно черная липидная мембрана сохраняется менее часа, что исключает долгосрочные эксперименты . Этот срок службы можно продлить путем точного структурирования поддерживающего отверстия, [9] химического сшивания липидов или желирования окружающего раствора для механической поддержки бислоя. [10] Работа в этой области продолжается, и время жизни в несколько часов станет возможным.

В отличие от пузырька или клеточной мембраны, в которых липидный бислой свернут в закрытую оболочку, поддерживаемый бислой представляет собой плоскую структуру, сидящую на твердой основе. Из-за этого воздействию свободного раствора подвергается только верхняя грань бислоя. Эта схема имеет преимущества и недостатки, связанные с изучением липидных бислоев. Одним из величайших преимуществ поддерживаемого бислоя является его стабильность. SLB остаются в значительной степени неповрежденными даже при воздействии высоких скоростей потока или вибрации и, в отличие от черных липидных мембран, наличие отверстий не разрушает весь бислой. Благодаря этой стабильности с поддерживаемыми бислоями возможны эксперименты продолжительностью несколько недель и даже месяцев, тогда как эксперименты BLM обычно ограничиваются часами. [11] Еще одним преимуществом поддерживаемого двухслойного слоя является то, что, поскольку он расположен на плоской твердой поверхности, его можно использовать для ряда инструментов определения характеристик, которые были бы невозможны или обеспечивали бы более низкое разрешение, если бы они выполнялись на свободно плавающем образце.
Одним из наиболее ярких примеров этого преимущества является использование методов механического зондирования, требующих прямого физического взаимодействия с образцом. Атомно-силовая микроскопия (АСМ) использовалась для визуализации разделения липидных фаз , [12] образования трансмембранных нанопор с последующей адсорбцией одиночной молекулы белка, [13] и сборки белка [14] с точностью до субнанометра без необходимости использования маркирующего красителя. . Совсем недавно АСМ также использовалась для прямого исследования механических свойств одиночных бислоев [15] и для проведения силовой спектроскопии отдельных мембранных белков. [16] Эти исследования были бы трудными или невозможными без использования поддерживаемых бислоев, поскольку поверхность клетки или пузырька относительно мягкая и со временем будет дрейфовать и колебаться. Другим примером физического зонда является использование кварцевых микровесов (QCM) для изучения кинетики связывания на поверхности бислоя. [17] Интерферометрия с двойной поляризацией — это оптический инструмент высокого разрешения для характеристики порядка и нарушений в липидных бислоях во время взаимодействий или фазовых переходов, предоставляющий дополнительные данные для измерений QCM. [18]
Многие современные методы флуоресцентной микроскопии также требуют жестко закрепленной плоской поверхности. Методы эванесцентного поля , такие как флуоресцентная микроскопия полного внутреннего отражения (TIRF) и поверхностный плазмонный резонанс (SPR), могут предложить чрезвычайно чувствительные измерения связывания аналита и оптических свойств двухслойных материалов, но могут работать только тогда, когда образец поддерживается на специализированных оптически функциональных материалах. Другой класс методов, применимых только к поддерживаемым бислоям, - это методы, основанные на оптической интерференции, такие как флуоресцентная интерференционно-контрастная микроскопия (FLIC) и отражательная интерференционно-контрастная микроскопия (RICM) или интерферометрическая рассеивающая микроскопия (iSCAT). [19] [20] Когда бислой поддерживается поверх отражающей поверхности, изменения интенсивности из-за деструктивных помех от этого интерфейса могут быть использованы для расчета с ангстремной точностью положения флуорофоров внутри бислоя. [21] И эванесцентный, и интерференционный методы обеспечивают субволновое разрешение только в одном измерении (z или вертикальном). Во многих случаях эта резолюция — это все, что необходимо. В конце концов, бислои очень малы только в одном измерении. В латеральном направлении бислой может простираться на многие микрометры или даже миллиметры. Но некоторые явления, такие как динамическая фазовая перегруппировка, действительно происходят в бислоях на латеральном субмикрометровом масштабе длины. Перспективным подходом к изучению этих структур является сканирующая оптическая микроскопия ближнего поля (НСОМ). [22] Как и АСМ, метод NSOM основан на сканировании микрообработанного наконечника для получения четко локализованного сигнала. Но в отличие от АСМ, NSOM использует оптическое, а не физическое взаимодействие с образцом, потенциально воздействуя на тонкие структуры в меньшей степени.

Еще одной важной особенностью поддерживаемых бислоев является способность формировать на поверхности рисунок для создания нескольких изолированных областей на одной подложке. Это явление было впервые продемонстрировано с использованием царапин или металлических «загонов», чтобы предотвратить смешивание между соседними областями, но при этом обеспечить свободную диффузию внутри любой одной области. [23] [24] Более поздние работы расширили эту концепцию за счет интеграции микрофлюидики , чтобы продемонстрировать, что стабильные градиенты состава могут формироваться в бислоях, [25] потенциально позволяя проводить массовые параллельные исследования разделения фаз, молекулярного связывания и клеточного ответа на искусственные липидные мембраны. Творческое использование концепции загона также позволило изучить динамическую реорганизацию мембранных белков на синаптическом интерфейсе. [26]
Одним из основных ограничений поддерживаемых бислоев является возможность нежелательного взаимодействия с подложкой. Хотя поддерживаемые бислои обычно не соприкасаются напрямую с поверхностью подложки, они разделены лишь очень тонким водным зазором. Размер и природа этой щели зависит от материала подложки [27] и вида липидов, но обычно составляет около 1 нм для цвиттер-ионных липидов, нанесенных на кремнезем , наиболее распространенную экспериментальную систему. [28] [29] Поскольку этот слой настолько тонкий, между бислоем и подложкой существует сильная гидродинамическая связь, что приводит к более низкому коэффициенту диффузии в поддерживаемых бислоях, чем для свободных бислоев того же состава. [30] Определенный процент поддерживаемого бислоя также будет полностью неподвижен, хотя точная природа и причина этих «закрепленных» сайтов все еще неясны. Для высококачественных бислоев, поддерживаемых жидкой фазой, доля неподвижной фракции обычно составляет около 1-5%. Для количественной оценки коэффициента диффузии и подвижной фракции исследователи, изучающие поддерживаемые бислои, часто сообщают данные FRAP .
Нежелательные взаимодействия с субстратом представляют собой гораздо более серьезную проблему при включении интегральных мембранных белков, особенно тех, у которых большие домены выходят за пределы ядра бислоя. Поскольку зазор между бислоем и подложкой очень тонкий, эти белки часто денатурируют на поверхности подложки и, следовательно, теряют всю функциональность. [31] Одним из подходов к решению этой проблемы является использование связанных полимером бислоев. В этих системах бислой поддерживается рыхлой сеткой гидратированных полимеров или гидрогеля , которая действует как спейсер и теоретически предотвращает денатурирующие взаимодействия субстрата. [32] На практике некоторый процент белков все равно потеряет подвижность и функциональность, вероятно, из-за взаимодействия с полимерными/липидными якорями. [30] Исследования в этой области продолжаются.
Использование связанной двухслойной липидной мембраны (t-BLM) еще больше увеличивает стабильность поддерживаемых мембран за счет химического закрепления липидов на твердом субстрате. [33]

Золото можно использовать в качестве субстрата из-за его инертного химического состава и тиолипидов для ковалентного связывания с золотом. Тиолипиды состоят из производных липидов, полярные головные группы которых расширены гидрофильными спейсерами, оканчивающимися тиоловой или дисульфидной группой , которая образует ковалентную связь с золотом, образуя самособирающиеся монослои (SAM).
Ограничение внутримембранной подвижности поддерживаемых липидных бислоев можно преодолеть путем введения полумембранных, перекрывающих привязные липиды [34] с бензилдисульфидом (DPL) и синтетического аналога архей, полных перекрывающих мембрану липидов с фитанольными цепями для стабилизации структуры и полиэтиленгликолевых звеньев. в качестве гидрофильного спейсера. Формирование бислоя достигается путем воздействия на золотой субстрат, покрытый липидами, липидов внешнего слоя либо в растворе этанола, либо в липосомах. [35]
Преимущество этого подхода заключается в том, что из-за гидрофильного пространства размером около 4 нм взаимодействие с подложкой минимально, а дополнительное пространство позволяет внедрять ионные каналы белка в бислой. Кроме того, разделительный слой создает ионный резервуар [36] , который легко позволяет измерять электрический импеданс переменного тока поперек бислоя.
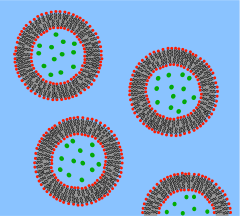
Везикула представляет собой липидный бислой, свернутый в сферическую оболочку, заключающую в себе небольшое количество воды и отделяющую ее от воды снаружи везикулы. Из-за этого фундаментального сходства с клеточной мембраной везикулы широко использовались для изучения свойств липидных бислоев. Другая причина, по которой везикулы используются так часто, заключается в том, что их относительно легко изготовить. Если образец обезвоженного липида подвергнуться воздействию воды, он спонтанно образует везикулы. [37] Эти начальные везикулы обычно многослойные (многостенные) и имеют широкий диапазон размеров от десятков нанометров до нескольких микрометров. [38] Такие методы, как обработка ультразвуком или экструзия через мембрану, необходимы для того, чтобы разбить эти начальные везикулы на более мелкие одностенные везикулы одинакового диаметра, известные как маленькие однослойные везикулы (SUV). Внедорожники обычно имеют диаметр от 50 до 200 нм. [39] Альтернативно, вместо синтеза везикул можно просто изолировать их из клеточных культур или образцов тканей. [40] Везикулы используются для транспортировки липидов, белков и многих других молекул внутри клетки, а также в клетку или из нее. Эти естественно изолированные везикулы состоят из сложной смеси различных липидов и белков, поэтому, хотя они обеспечивают больший реализм для изучения конкретных биологических явлений, простые искусственные везикулы предпочтительнее для изучения фундаментальных свойств липидов.
Поскольку искусственные внедорожники могут производиться в больших количествах, они подходят для исследований объемных материалов, таких как дифракция рентгеновских лучей для определения шага решетки [41] и дифференциальная сканирующая калориметрия для определения фазовых переходов. [42] Интерферометрия с двойной поляризацией может измерять одноламелярные и многоламелярные структуры, а также вставку и разрушение везикул в формате анализа без меток. [43] Везикулы также можно пометить флуоресцентными красителями, чтобы обеспечить чувствительные анализы слияния на основе FRET . [44]
Несмотря на флуоресцентную маркировку, часто бывает сложно выполнить детальную визуализацию внедорожников просто потому, что они настолько малы. Для борьбы с этой проблемой исследователи используют гигантские однослойные везикулы (ГУВ). GUV достаточно велики (1–200 мкм), чтобы их можно было изучать с помощью традиционной флуоресцентной микроскопии, и находятся в том же диапазоне размеров, что и большинство биологических клеток. Таким образом, они используются в качестве имитации клеточных мембран для исследований in vitro в области молекулярной и клеточной биологии. По этой причине многие исследования липидных рафтов в искусственных липидных системах проводились с использованием GUV. [45] По сравнению с поддерживаемыми бислоями, GUV представляют собой более «естественную» среду, поскольку нет жесткой поверхности, которая могла бы вызвать дефекты, повлиять на свойства мембраны или денатурировать белки. Поэтому GUV часто используются для изучения ремоделирования мембран и других взаимодействий белок-мембрана in vitro. Существует множество методов инкапсуляции белков или других биологических реагентов внутри таких везикул, что делает GUV идеальной системой для воссоздания (и исследования) in vitro клеточных функций в клеточноподобной модельной мембранной среде. [46] Эти методы включают микрофлюидные методы, которые позволяют высокопроизводительно производить везикул одинакового размера. [47]
Бислои интерфейса капель (DIB) представляют собой капли, заключенные в фосфолипиды, которые при контакте образуют бислои. [48] [49] Капли окружены маслом, а фосфолипиды диспергированы либо в воде, либо в масле. [48] В результате фосфолипиды спонтанно образуют монослой на каждой границе раздела масло-вода. [48] DIBs можно формировать для создания тканеподобного материала со способностью образовывать асимметричные бислои, восстанавливать белки и белковые каналы или создавать для использования в изучении электрофизиологии. [50] [51] [52] [53] [54] Расширенные сети DIB могут быть сформированы либо с использованием капельных микрофлюидных устройств, либо с использованием капельных принтеров. [54] [55]
Детергентные мицеллы [56] представляют собой еще один класс модельных мембран, которые обычно используются для очистки и изучения мембранных белков , хотя у них отсутствует липидный бислой. В водных растворах мицеллы представляют собой совокупности амфипатических молекул, гидрофильные головки которых подвергаются воздействию растворителя, а гидрофобные хвосты находятся в центре. Мицеллы могут солюбилизировать мембранные белки, частично инкапсулируя их и защищая их гидрофобные поверхности от растворителя.
Бицеллы представляют собой родственный класс модельных мембран [57] , обычно состоящих из двух липидов, один из которых образует липидный бислой, а другой образует амфипатическую, мицеллоподобную сборку, защищающую центр бислоя от окружающих молекул растворителя. Бицеллы можно рассматривать как сегмент бислоя, инкапсулированный и солюбилизированный мицеллой. Бицеллы намного меньше липосом, поэтому их можно использовать в таких экспериментах, как ЯМР- спектроскопия, где более крупные везикулы не подходят.
Нанодиски [58] состоят из сегмента бислоя, инкапсулированного амфипатической белковой оболочкой, а не липидным или детергентным слоем. Нанодиски более стабильны, чем бицеллы и мицеллы при низких концентрациях, и имеют очень четко выраженный размер (в зависимости от типа белковой оболочки, от 10 до 20 нм ). Мембранные белки, включенные в нанодиски и солюбилизированные ими, можно изучать с помощью широкого спектра биофизических методов. [59] [60]