Эпидемиология — это изучение и анализ распределения (кто, когда и где), закономерностей и детерминант состояния здоровья и болезней в определенной группе населения .
Это краеугольный камень общественного здравоохранения , который формирует политические решения и практику, основанную на фактических данных, путем выявления факторов риска заболеваний и целей для профилактического здравоохранения . Эпидемиологи помогают в разработке исследований, сборе и статистическом анализе данных, корректируют интерпретацию и распространение результатов (включая экспертную оценку и периодический систематический обзор ). Эпидемиология помогла разработать методологию, используемую в клинических исследованиях , исследованиях общественного здравоохранения и, в меньшей степени, в фундаментальных исследованиях в области биологических наук. [1]
Основные области эпидемиологических исследований включают этиологию заболеваний, передачу , расследование вспышек , надзор за заболеваниями , экологическую эпидемиологию , судебную эпидемиологию , профессиональную эпидемиологию , скрининг , биомониторинг и сравнение эффектов лечения, например, в клинических испытаниях . Эпидемиологи опираются на другие научные дисциплины, такие как биология, чтобы лучше понять процессы заболеваний, статистику , чтобы эффективно использовать данные и делать соответствующие выводы, социальные науки , чтобы лучше понять непосредственные и отдаленные причины, и инженерию для оценки воздействия .
Эпидемиология , буквально означающая «изучение того, что находится на людях», происходит от греческого epi 'на, среди' demos 'люди, район' и logos 'изучение, слово, дискурс', что предполагает, что оно применимо только к человеческим популяциям. Тем не менее, этот термин широко используется в исследованиях зоологических популяций (ветеринарная эпидемиология), хотя термин « эпизоология » доступен, и он также применялся к исследованиям популяций растений (ботаническая или эпидемиология болезней растений ). [2]
Различие между «эпидемическим» и «эндемичным» впервые было проведено Гиппократом [3], чтобы отличить болезни, которые «посещают» население (эпидемические), от болезней, которые «проживают внутри» населения (эндемические). [4] Термин «эпидемиология», по-видимому, впервые был использован для описания изучения эпидемий в 1802 году испанским врачом Хоакином де Вильяльбой в работе Epidemiología Española . [4] Эпидемиологи также изучают взаимодействие болезней в популяции, состояние, известное как синдемия .
Термин эпидемиология в настоящее время широко применяется для описания и причин не только эпидемических, инфекционных заболеваний, но и заболеваний в целом, включая связанные с ними состояния. Некоторые примеры тем, изучаемых эпидемиологией, включают высокое кровяное давление, психические заболевания и ожирение . Таким образом, эта эпидемиология основана на том, как характер заболевания вызывает изменение в функциях человека.
Греческий врач Гиппократ , которого учил Демокрит, был известен как отец медицины , [5] [6] искал логику в болезни; он был первым человеком, который, как известно, исследовал связь между возникновением болезни и влиянием окружающей среды. [7] Гиппократ считал, что болезнь человеческого тела вызывается дисбалансом четырех жидкостей (черной желчи, желтой желчи, крови и мокроты). Лекарством от болезни было удаление или добавление соответствующей жидкости для баланса тела. Это убеждение привело к применению кровопускания и диеты в медицине. [8] Он ввел термины эндемический (для болезней, которые обычно встречаются в одних местах, но не в других) и эпидемический (для болезней, которые наблюдаются в одно время, но не в другое). [9]
В середине XVI века врач из Вероны по имени Джироламо Фракасторо первым выдвинул теорию о том, что очень маленькие, невидимые частицы, вызывающие болезни, являются живыми. Считалось, что они могут распространяться по воздуху, размножаться сами по себе и уничтожаться огнем. Таким образом, он опроверг теорию миазмов Галена ( ядовитый газ у больных людей). В 1543 году он написал книгу De contagione et contagiosis morbis , в которой он первым пропагандировал личную и экологическую гигиену для предотвращения болезней. Разработка достаточно мощного микроскопа Антони ван Левенгуком в 1675 году предоставила визуальное доказательство живых частиц, согласующееся с микробной теорией болезней . [ требуется ссылка ]
Во времена династии Мин У Юкэ (1582–1652) разработал идею о том, что некоторые болезни вызываются трансмиссивными агентами, которых он назвал Ли Ци (戾气 или чумные факторы), когда он наблюдал, как вокруг него бушуют различные эпидемии между 1641 и 1644 годами. [10] Его книгу Вэнь И Лунь (瘟疫论, Трактат о чуме/Трактат об эпидемических заболеваниях) можно считать основной этиологической работой, которая выдвинула эту концепцию. [11] Его концепции все еще рассматривались при анализе вспышки атипичной пневмонии ВОЗ в 2004 году в контексте традиционной китайской медицины. [12]
Другой пионер, Томас Сиденхэм (1624–1689), был первым, кто различил лихорадки лондонцев в конце 1600-х годов. Его теории о лечении лихорадок встретили большое сопротивление со стороны традиционных врачей того времени. Он не смог найти первоначальную причину оспенной лихорадки, которую он исследовал и лечил. [8]
Джон Граунт , галантерейщик и любитель статистики, опубликовал «Естественные и политические наблюдения... за счет смертей» в 1662 году. В нем он проанализировал списки смертности в Лондоне до Великой чумы , представил одну из первых таблиц смертности и сообщил о временных тенденциях для многих болезней, новых и старых. Он предоставил статистические доказательства для многих теорий о болезнях, а также опроверг некоторые распространенные идеи о них. [ необходима цитата ]
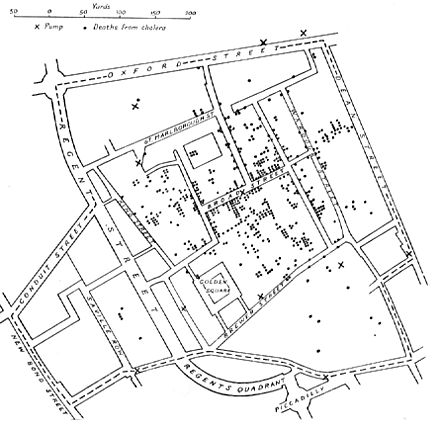
Джон Сноу известен своими исследованиями причин эпидемий холеры в 19 веке , а также известен как отец (современной) эпидемиологии. [13] [14] Он начал с того, что заметил значительно более высокий уровень смертности в двух районах, снабжаемых компанией Southwark Company. Его определение насоса на Брод-стрит как причины эпидемии в Сохо считается классическим примером эпидемиологии. Сноу использовал хлор в попытке очистить воду и снял ручку; это положило конец вспышке. Это было воспринято как важное событие в истории общественного здравоохранения и расценено как основополагающее событие науки эпидемиологии, которое помогло сформировать политику общественного здравоохранения во всем мире. [15] [16] Однако исследования Сноу и профилактические меры по предотвращению дальнейших вспышек не были полностью приняты или реализованы на практике до его смерти из-за преобладающей в то время теории миазмов , модели заболевания, в которой плохое качество воздуха считалось причиной болезни. Это использовалось для оправдания высоких показателей заболеваемости в бедных районах вместо решения основных проблем плохого питания и санитарии, и его работа доказала ложность этого утверждения. [17]
Другие пионеры включают датского врача Петера Антона Шлейснера, который в 1849 году рассказал о своей работе по профилактике эпидемии столбняка новорожденных на островах Вестманна в Исландии . [18] [19] Другим важным пионером был венгерский врач Игнац Земмельвейс , который в 1847 году снизил детскую смертность в венской больнице, введя процедуру дезинфекции. Его выводы были опубликованы в 1850 году, но его работа была плохо принята его коллегами, которые прекратили процедуру. Дезинфекция не стала широко практиковаться, пока британский хирург Джозеф Листер не «открыл» антисептики в 1865 году в свете работы Луи Пастера . [ необходима ссылка ]
В начале 20 века математические методы были введены в эпидемиологию Рональдом Россом , Джанет Лейн-Клейпон , Андерсоном Греем МакКендриком и другими. [20] [21] [22] [23] Параллельно в 1920-х годах немецко-швейцарский патолог Макс Асканази и другие основали Международное общество географической патологии для систематического изучения географической патологии рака и других неинфекционных заболеваний среди населения в разных регионах. После Второй мировой войны Ричард Долл и другие непатологи присоединились к этой области и разработали передовые методы изучения рака, заболевания с закономерностями и способами возникновения, которые не могли быть надлежащим образом изучены с помощью методов, разработанных для эпидемий инфекционных заболеваний. Географическая патология в конечном итоге объединилась с эпидемиологией инфекционных заболеваний, чтобы создать область, которая является эпидемиологией сегодня. [24]
Другим прорывом стала публикация в 1954 году результатов исследования британских врачей под руководством Ричарда Долла и Остина Брэдфорда Хилла , которое предоставило очень веские статистические данные в поддержку связи между курением табака и раком легких . [ необходима ссылка ]
В конце 20-го века, с развитием биомедицинских наук, ряд молекулярных маркеров в крови, других биологических образцах и окружающей среде были идентифицированы как предикторы развития или риска определенного заболевания. Эпидемиологические исследования для изучения связи между этими биомаркерами, проанализированными на молекулярном уровне, и заболеванием получили общее название « молекулярная эпидемиология ». В частности, « генетическая эпидемиология » использовалась для эпидемиологии генетической изменчивости зародышевой линии и заболевания. Генетическая изменчивость обычно определяется с использованием ДНК из лейкоцитов периферической крови. [ необходима цитата ]
Начиная с 2000-х годов широко проводились исследования ассоциаций по всему геному (GWAS) для выявления генетических факторов риска многих заболеваний и состояний здоровья. [25]
Хотя большинство исследований молекулярной эпидемиологии по-прежнему используют традиционные системы диагностики и классификации заболеваний, все больше осознается, что прогрессирование заболевания представляет собой по своей сути гетерогенные процессы, отличающиеся от человека к человеку. Концептуально, у каждого человека есть уникальный процесс заболевания, отличный от любого другого человека («принцип уникальной болезни»), [26] [27] учитывая уникальность экспосомы ( совокупность эндогенных и экзогенных / экологических воздействий) и ее уникальное влияние на молекулярный патологический процесс у каждого человека. Исследования по изучению связи между воздействием и молекулярно-патологической сигнатурой заболевания (особенно рака ) стали все более распространенными в течение 2000-х годов. Однако использование молекулярной патологии в эпидемиологии создало уникальные проблемы, включая отсутствие исследовательских руководств и стандартизированных статистических методологий, а также нехватку междисциплинарных экспертов и программ обучения. [28] Кроме того, концепция гетерогенности заболеваний, по-видимому, противоречит давней предпосылке в эпидемиологии, что люди с одинаковым названием заболевания имеют схожую этиологию и процессы заболевания. Чтобы решить эти проблемы и продвинуть науку о здоровье населения в эпоху молекулярной точной медицины , «молекулярная патология» и «эпидемиология» были объединены для создания новой междисциплинарной области « молекулярной патологической эпидемиологии » (МПЭ), [29] [30] определяемой как «эпидемиология молекулярной патологии и гетерогенности заболеваний». В МПЭ исследователи анализируют взаимосвязи между (A) факторами окружающей среды, питания, образа жизни и генетическими факторами; (B) изменениями в клеточных или внеклеточных молекулах; и (C) эволюцией и прогрессированием заболеваний. Лучшее понимание гетерогенности патогенеза заболеваний будет способствовать дальнейшему выяснению этиологии заболеваний. Подход МПЭ может применяться не только к неопластическим заболеваниям, но и к неопухолевым заболеваниям. [31] Концепция и парадигма MPE получили широкое распространение в 2010-х годах. [32] [33] [34] [35] [36] [37] [38] [ чрезмерное цитирование ]
К 2012 году было признано, что эволюция многих патогенов достаточно быстра, чтобы иметь высокую значимость для эпидемиологии, и что, следовательно, можно многого добиться с помощью междисциплинарного подхода к инфекционным заболеваниям, объединяющего эпидемиологию и молекулярную эволюцию, чтобы «информировать стратегии контроля или даже лечение пациентов». [39] [40] Современные эпидемиологические исследования могут использовать расширенную статистику и машинное обучение для создания прогностических моделей , а также для определения эффектов лечения. [41] [42] Растет признание того, что широкий спектр современных источников данных, многие из которых не относятся к здравоохранению или эпидемиологии, можно использовать для эпидемиологических исследований. Такая цифровая эпидемиология может включать данные из поиска в Интернете, записи мобильных телефонов и розничные продажи лекарств. [ необходима ссылка ]

Эпидемиологи используют ряд дизайнов исследований от наблюдательных до экспериментальных и, как правило, классифицируются как описательные (включающие оценку данных, охватывающих время, место и человека), аналитические (направленные на дальнейшее изучение известных ассоциаций или предполагаемых отношений) и экспериментальные (термин, часто приравниваемый к клиническим или общественным испытаниям методов лечения и других вмешательств). В наблюдательных исследованиях природе позволено «идти своим чередом», поскольку эпидемиологи наблюдают со стороны. Напротив, в экспериментальных исследованиях эпидемиолог контролирует все факторы, входящие в определенное исследование случая. [43] Эпидемиологические исследования направлены, где это возможно, на выявление беспристрастных связей между воздействиями, такими как алкоголь или курение, биологические агенты , стресс или химические вещества , со смертностью или заболеваемостью . Выявление причинно-следственных связей между этими воздействиями и результатами является важным аспектом эпидемиологии. Современные эпидемиологи используют информатику и инфодемиологию [44] [45] в качестве инструментов. [ необходима ссылка ] [46] [47] [48]
Наблюдательные исследования имеют два компонента: описательный и аналитический. Описательные наблюдения относятся к «кто, что, где и когда происходит состояние, связанное со здоровьем». Однако аналитические наблюдения больше имеют дело с «как» события, связанного со здоровьем. [43] Экспериментальная эпидемиология содержит три типа случаев: рандомизированные контролируемые испытания (часто используемые для тестирования нового лекарства или препарата), полевые испытания (проводимые на людях с высоким риском заражения болезнью) и общественные испытания (исследования заболеваний социального происхождения). [43]
Термин «эпидемиологическая триада» используется для описания пересечения Хозяина , Агента и Окружающей Среды при анализе вспышки. [49]
Серия случаев может относиться к качественному исследованию опыта одного пациента или небольшой группы пациентов со схожим диагнозом или к статистическому фактору, потенциально способному вызывать заболевание в периоды, когда они не подвергались воздействию. [50]
Первый тип исследования является чисто описательным и не может использоваться для выводов об общей популяции пациентов с этим заболеванием. Эти типы исследований, в которых проницательный клиницист выявляет необычную особенность заболевания или истории пациента, могут привести к формулированию новой гипотезы. Используя данные из серии, можно провести аналитические исследования для изучения возможных причинных факторов. Они могут включать исследования случай-контроль или перспективные исследования. Исследование случай-контроль будет включать сопоставление сопоставимых контролей без заболевания со случаями в серии. Перспективное исследование будет включать отслеживание серии случаев с течением времени для оценки естественной истории заболевания. [51]
Последний тип, более формально описываемый как самоконтролируемые исследования серии случаев, делит время наблюдения за отдельными пациентами на периоды воздействия и невоздействия и использует процессы регрессии Пуассона с фиксированными эффектами для сравнения частоты возникновения данного результата между периодами воздействия и невоздействия. Этот метод широко использовался при изучении побочных реакций на вакцинацию и, как было показано, в некоторых обстоятельствах обеспечивает статистическую мощность, сопоставимую с той, которая доступна в когортных исследованиях. [ необходима цитата ]
Исследования случай-контроль отбирают субъектов на основе их статуса заболевания. Это ретроспективное исследование. Группа лиц с положительным результатом на заболевание (группа «случай») сравнивается с группой лиц с отрицательным результатом на заболевание (группа «контроль»). Контрольная группа в идеале должна быть из той же популяции, которая дала начало случаям. Исследование случай-контроль рассматривает во времени потенциальные воздействия, с которыми могли столкнуться обе группы (случаи и контроль). Строится таблица 2×2, отображающая случаи воздействия (A), контроли воздействия (B), случаи не воздействия (C) и контроли не воздействия (D). Статистика, полученная для измерения ассоциации, представляет собой отношение шансов (OR), которое представляет собой отношение шансов воздействия в случаях (A/C) к шансам воздействия в контроле (B/D), т. е. OR = (AD/BC). [ необходима цитата ]
Если OR значительно больше 1, то вывод таков: «Лица с заболеванием, скорее всего, подверглись воздействию», тогда как если он близок к 1, то воздействие и заболевание, скорее всего, не связаны. Если OR намного меньше единицы, то это говорит о том, что воздействие является защитным фактором в возникновении заболевания. Исследования случай-контроль обычно проводятся быстрее и более экономически эффективны, чем когортные исследования , но они чувствительны к смещению (например, смещению памяти и смещению отбора ). Основная проблема заключается в определении подходящей контрольной группы; распределение воздействия среди контрольной группы должно быть репрезентативным для распределения в популяции, которая привела к возникновению случаев. Этого можно достичь, взяв случайную выборку из исходной популяции, подверженной риску. Это приводит к тому, что контрольная группа может содержать людей с изучаемым заболеванием, когда заболевание имеет высокий уровень заболеваемости в популяции. [ необходима цитата ]
Основным недостатком исследований случай-контроль является то, что для того, чтобы считаться статистически значимым, минимальное количество случаев, необходимое для 95% доверительного интервала, связано с отношением шансов с помощью уравнения:
где N — отношение случаев к контролям. По мере того, как отношение шансов приближается к 1, количество случаев, необходимых для статистической значимости, возрастает до бесконечности; делая исследования случай-контроль практически бесполезными при низком отношении шансов. Например, для отношения шансов 1,5 и случаев = контролям, таблица, показанная выше, будет выглядеть следующим образом:
Для коэффициента шансов 1,1:
Когортные исследования отбирают субъектов на основе их статуса воздействия. Субъекты исследования должны быть подвержены риску изучаемого исхода в начале когортного исследования; это обычно означает, что они не должны быть больны, когда когортное исследование начинается. Когорта отслеживается во времени для оценки их более позднего статуса исхода. Примером когортного исследования может служить исследование когорты курящих и некурящих с течением времени для оценки заболеваемости раком легких. Строится та же таблица 2×2, что и в исследовании случай-контроль. Однако полученная точечная оценка представляет собой относительный риск (ОР), который представляет собой вероятность заболевания для человека в группе, подвергшейся воздействию, P e = A / ( A + B ) по сравнению с вероятностью заболевания для человека в группе, не подвергшейся воздействию, P u = C / ( C + D ), т. е. ОР = P e / P u .
Как и в случае с OR, RR больше 1 указывает на связь, из чего можно сделать вывод: «У лиц, подвергшихся воздействию, вероятность развития заболевания была выше».
Проспективные исследования имеют много преимуществ по сравнению с исследованиями случай-контроль. RR является более мощной мерой эффекта, чем OR, поскольку OR является всего лишь оценкой RR, поскольку истинная заболеваемость не может быть рассчитана в исследовании случай-контроль, где субъекты отбираются на основе статуса заболевания. Временность может быть установлена в проспективном исследовании, и факторы, искажающие результаты, легче контролировать. Однако они более затратны, и существует большая вероятность потери субъектов для последующего наблюдения на основе длительного периода времени, в течение которого отслеживается когорта.
Когортные исследования также ограничены тем же уравнением для числа случаев, что и для когортных исследований, но если базовый уровень заболеваемости в исследуемой популяции очень низок, необходимое число случаев уменьшается на 1 ⁄ 2 .
Хотя эпидемиологию иногда рассматривают как набор статистических инструментов, используемых для выяснения взаимосвязи между воздействием факторов и последствиями для здоровья, более глубокое понимание этой науки заключается в выявлении причинно-следственных связей.
« Корреляция не подразумевает причинно-следственную связь » — общая тема для большей части эпидемиологической литературы. Для эпидемиологов ключевое значение имеет термин вывод . Корреляция или, по крайней мере, связь между двумя переменными является необходимым, но недостаточным критерием для вывода о том, что одна переменная вызывает другую. Эпидемиологи используют собранные данные и широкий спектр биомедицинских и психосоциальных теорий итеративным образом для создания или расширения теории, проверки гипотез и вынесения обоснованных, обоснованных утверждений о том, какие связи являются причинно-следственными, и о том, как именно они являются причинно-следственными.
Эпидемиологи подчеркивают, что понимание « одна причина – одно следствие » является упрощенным заблуждением. [52] Большинство результатов, будь то болезнь или смерть, вызваны цепочкой или сетью, состоящей из многих компонентных причин. [53] Причины можно разделить на необходимые, достаточные или вероятностные условия. Если необходимое условие может быть идентифицировано и проконтролировано (например, антитела к возбудителю болезни, энергия при травме), вредного результата можно избежать (Робертсон, 2015). Одним из инструментов, регулярно используемых для концептуализации многопричинности, связанной с болезнью, является модель причинного пирога . [54]
В 1965 году Остин Брэдфорд Хилл предложил ряд соображений, помогающих оценить доказательства причинно-следственной связи, [55] которые стали широко известны как « критерии Брэдфорда Хилла ». В отличие от явных намерений их автора, соображения Хилла теперь иногда преподаются как контрольный список, который должен быть реализован для оценки причинно-следственной связи. [56] Сам Хилл сказал: «Ни одна из моих девяти точек зрения не может предоставить неоспоримых доказательств за или против гипотезы причины и следствия, и ни одна не может быть обязательной » . [55]
Эпидемиологические исследования могут лишь доказать, что агент мог вызвать, но не то, что он действительно вызвал, эффект в каждом конкретном случае:
Эпидемиология занимается частотой заболеваний в популяциях и не рассматривает вопрос о причине заболевания отдельного человека. Этот вопрос, иногда называемый конкретной причинной связью, выходит за рамки науки эпидемиологии. Эпидемиология имеет свои пределы в точке, где делается вывод о том, что связь между агентом и болезнью является причинной (общая причинная связь), и где определена величина избыточного риска, приписываемого агенту; то есть эпидемиология занимается вопросом, может ли агент вызвать болезнь, а не вопросом о том, действительно ли агент вызвал болезнь конкретного истца. [57]
В законодательстве США эпидемиология сама по себе не может доказать, что причинно-следственная связь не существует в целом. И наоборот, она может быть (и в некоторых обстоятельствах используется) судами США в индивидуальном случае для обоснования вывода о том, что причинно-следственная связь существует, на основе баланса вероятностей .
Субдисциплина судебной эпидемиологии направлена на расследование конкретных причин заболеваний или травм у отдельных лиц или групп лиц в случаях, когда причинно-следственная связь оспаривается или неясна, для представления в юридических учреждениях.
Эпидемиологическая практика и результаты эпидемиологического анализа вносят значительный вклад в формирование структур управления здравоохранением на уровне населения.
Управление здравоохранением на уровне населения включает в себя возможность:
Современное управление здравоохранением на основе населения является сложным, требующим множественного набора навыков (медицинских, политических, технологических, математических и т. д.), из которых эпидемиологическая практика и анализ являются основным компонентом, который объединен с управленческой наукой для предоставления эффективной и действенной медицинской помощи и руководства по охране здоровья для населения. Эта задача требует дальновидной способности современных подходов к управлению рисками, которые преобразуют факторы риска для здоровья, заболеваемость, распространенность и статистику смертности (полученную из эпидемиологического анализа) в метрики управления, которые не только направляют то, как система здравоохранения реагирует на текущие проблемы со здоровьем населения, но и то, как можно управлять системой здравоохранения, чтобы лучше реагировать на будущие потенциальные проблемы со здоровьем населения. [58]
Примерами организаций, которые используют управление здравоохранением на уровне населения, используя работу и результаты эпидемиологической практики, являются Канадская стратегия борьбы с раком, Программы по контролю над табаком Министерства здравоохранения Канады, Фонд Рика Хансена, Канадская исследовательская инициатива по контролю над табаком. [59] [60] [61]
Каждая из этих организаций использует структуру управления здравоохранением на уровне населения под названием «Жизнь в опасности», которая объединяет эпидемиологический количественный анализ с демографическими данными, операционными исследованиями агентств здравоохранения и экономикой для выполнения следующих задач:
Прикладная эпидемиология — это практика использования эпидемиологических методов для защиты или улучшения здоровья населения. Прикладная полевая эпидемиология может включать в себя исследование вспышек инфекционных и неинфекционных заболеваний, показателей смертности и заболеваемости, а также состояния питания, среди прочих показателей здоровья, с целью передачи результатов тем, кто может реализовать соответствующую политику или меры по контролю заболеваний.
Поскольку наблюдение и отчетность о заболеваниях и других факторах здоровья становятся все более сложными в ситуациях гуманитарного кризиса, методологии, используемые для предоставления данных, подвергаются риску. Одно исследование показало, что менее половины (42,4%) обследований по питанию, отобранных из гуманитарных контекстов, правильно рассчитали распространенность недоедания, и только треть (35,3%) обследований соответствовали критериям качества. Среди обследований смертности только 3,2% соответствовали критериям качества. Поскольку статус питания и показатели смертности помогают определить серьезность кризиса, отслеживание и отчетность по этим факторам здоровья имеют решающее значение.
Реестры жизненно важных событий обычно являются наиболее эффективными способами сбора данных, но в гуманитарных контекстах эти реестры могут отсутствовать, быть ненадежными или недоступными. Таким образом, смертность часто неточно измеряется с использованием либо перспективного демографического наблюдения, либо ретроспективных исследований смертности. Перспективное демографическое наблюдение требует больших трудозатрат и его трудно реализовать в рассредоточенной популяции. Ретроспективные исследования смертности подвержены предвзятости отбора и отчетности. Другие методы разрабатываются, но пока не являются общепринятой практикой. [62] [63] [64] [65]
Концепция волн в эпидемиях имеет последствия, особенно для инфекционных заболеваний . Рабочее определение термина «эпидемическая волна» основано на двух ключевых особенностях: 1) она включает периоды восходящих или нисходящих тенденций, и 2) эти увеличения или уменьшения должны быть существенными и устойчивыми в течение определенного периода времени, чтобы отличать их от незначительных колебаний или ошибок в отчетности. [66] Использование последовательного научного определения заключается в предоставлении последовательного языка, который можно использовать для сообщения и понимания прогрессирования пандемии COVID-19, что поможет организациям здравоохранения и политикам в планировании и распределении ресурсов.
Различные области эпидемиологии имеют разные уровни достоверности. Одним из способов оценки достоверности результатов является соотношение ложноположительных результатов (заявленных эффектов, которые не являются правильными) к ложноотрицательным результатам (исследованиям, которые не подтверждают истинный эффект). В генетической эпидемиологии исследования генов-кандидатов могут давать более 100 ложноположительных результатов на каждый ложноотрицательный результат. Напротив, общегеномная ассоциация, по-видимому, близка к обратному, с одним ложноположительным результатом на каждые 100 или более ложноотрицательных результатов. [67] Это соотношение улучшилось с течением времени в генетической эпидемиологии, поскольку область приняла строгие критерии. Напротив, другие области эпидемиологии не требовали такой строгой отчетности и в результате являются гораздо менее надежными. [67]
Случайная ошибка является результатом колебаний вокруг истинного значения из-за изменчивости выборки. Случайная ошибка — это просто случайность. Она может возникнуть во время сбора данных, кодирования, передачи или анализа. Примерами случайных ошибок являются плохо сформулированные вопросы, неправильное понимание при интерпретации индивидуального ответа конкретного респондента или типографская ошибка во время кодирования. Случайная ошибка влияет на измерение временным, непоследовательным образом, и ее невозможно исправить для случайной ошибки. Во всех процедурах выборки есть случайная ошибка — ошибка выборки . [ необходима цитата ]
Точность эпидемиологических переменных является мерой случайной ошибки. Точность также обратно пропорциональна случайной ошибке, так что уменьшение случайной ошибки означает увеличение точности. Доверительные интервалы вычисляются для демонстрации точности оценок относительного риска. Чем уже доверительный интервал, тем точнее оценка относительного риска.
Существует два основных способа уменьшения случайной ошибки в эпидемиологическом исследовании . Первый — увеличить размер выборки исследования. Другими словами, добавить больше субъектов в ваше исследование. Второй — уменьшить вариабельность измерений в исследовании. Этого можно достичь, используя более точное измерительное устройство или увеличив количество измерений.
Обратите внимание, что если размер выборки или количество измерений увеличиваются, или приобретается более точный измерительный инструмент, то стоимость исследования обычно увеличивается. Обычно существует непростой баланс между потребностью в адекватной точности и практическим вопросом стоимости исследования.
Систематическая ошибка или смещение возникает, когда между истинным значением (в популяции) и наблюдаемым значением (в исследовании) есть разница по любой причине, кроме изменчивости выборки. Примером систематической ошибки является случай, когда, неизвестно вам, используемый вами пульсоксиметр настроен неправильно и добавляет две точки к истинному значению каждый раз, когда выполняется измерение. Измерительное устройство может быть точным, но не точным . Поскольку ошибка происходит в каждом случае, она является систематической. Выводы, которые вы делаете на основе этих данных, все равно будут неверными. Но ошибку можно воспроизвести в будущем (например, используя тот же неправильно настроенный прибор).
Еще одним примером систематической ошибки является ошибка в кодировании, которая влияет на все ответы на данный вопрос.
Валидность исследования зависит от степени систематической ошибки. Валидность обычно делится на два компонента:
Смещение отбора происходит, когда субъекты исследования выбираются или становятся частью исследования в результате третьей, неизмеренной переменной, которая связана как с воздействием, так и с интересующим результатом. [68] Например, неоднократно отмечалось, что курильщики сигарет и некурящие, как правило, различаются по уровню участия в исследовании. (Сакетт Д. приводит пример Сельцера и др., в котором 85% некурящих и 67% курильщиков вернули отправленные по почте анкеты.) [69] Такое различие в ответах не приведет к смещению, если оно также не связано с систематическим различием в результатах между двумя группами ответов.
Информационное смещение — это смещение, возникающее из-за систематической ошибки в оценке переменной. [70] Примером этого является смещение памяти. Типичный пример снова приводит Сакетт в своем обсуждении исследования, изучающего влияние определенных воздействий на здоровье плода: «при опросе матерей, чьи недавние беременности закончились гибелью плода или пороками развития (случаи), и соответствующей группы матерей, чьи беременности закончились нормально (контрольная группа), было обнаружено, что 28% первых, но только 20% вторых, сообщили о воздействии препаратов, которое не могло быть подтверждено ни в более ранних проспективных интервью, ни в других медицинских записях». [69] В этом примере смещение памяти, вероятно, возникло в результате того, что женщины, у которых были выкидыши, имели очевидную тенденцию лучше вспоминать и, следовательно, сообщать о предыдущих воздействиях.
Традиционно смешивание определяется как смещение, возникающее из-за совместного появления или смешивания эффектов посторонних факторов, называемых конфаундерами, с основным интересующим эффектом(ами). [70] [71] Более позднее определение смешивания использует понятие контрфактуальных эффектов. [71] Согласно этой точке зрения, когда кто-то наблюдает интересующий результат, скажем, Y = 1 (в отличие от Y = 0), в данной популяции A, которая полностью подвергается воздействию (т. е. воздействие X = 1 для каждой единицы популяции), риск этого события будет равен R A1 . Контрфактуальный или ненаблюдаемый риск R A0 соответствует риску, который наблюдался бы, если бы эти же люди не подвергались воздействию (т. е. X = 0 для каждой единицы популяции). Таким образом, истинный эффект воздействия равен: R A1 − R A0 (если интересуют различия в рисках) или R A1 / R A0 (если интересуются относительным риском). Поскольку контрфактуальный риск R A0 ненаблюдаем, мы аппроксимируем его с помощью второй популяции B и фактически измеряем следующие отношения: R A1 − R B0 или R A1 / R B0 . В этой ситуации смешение происходит, когда R A0 ≠ R B0 . [71] (Примечание: в примере предполагаются бинарные переменные результата и воздействия.)
Некоторые эпидемиологи предпочитают рассматривать смешение отдельно от общих категорий предвзятости, поскольку, в отличие от смещения отбора и информационной предвзятости, смешение возникает из-за реальных причинно-следственных эффектов. [68]
Немногие университеты предлагают эпидемиологию в качестве курса обучения на уровне бакалавриата. [ требуется ссылка ] Программа бакалавриата существует в Университете Джонса Хопкинса , в рамках которой студенты, специализирующиеся в области общественного здравоохранения, могут посещать курсы магистратуры, включая эпидемиологию, во время своего последнего года обучения в Школе общественного здравоохранения Блумберга . [72] В дополнение к своим магистерским и докторским степеням в области эпидемиологии, Школа общественного здравоохранения Мичиганского университета с 2017 года предлагает программы бакалавриата, которые включают курсовую работу по эпидемиологии. [73] [74]
Хотя эпидемиологические исследования проводятся представителями различных дисциплин, в докторантуре по фармацевтике , медицине , ветеринарии , социальной работе , подологии , сестринскому делу , физиотерапии и клинической психологии в дополнение к формальной подготовке, которую получают магистранты и докторанты в области общественного здравоохранения, предусмотрены различные уровни обучения эпидемиологическим методам.
Как специалисты по общественному здравоохранению, эпидемиологи работают в различных условиях. Некоторые эпидемиологи работают «в поле» (т. е. в обществе; обычно [ по мнению кого? ] в службе общественного здравоохранения) и часто находятся на передовой расследования и борьбы со вспышками заболеваний. [ необходима цитата ] Другие работают в некоммерческих организациях, университетах, больницах или крупных государственных учреждениях (например, государственные и местные департаменты здравоохранения в Соединенных Штатах), министерствах здравоохранения, «Врачах без границ » , Центрах по контролю и профилактике заболеваний (CDC), Агентстве по охране здоровья , Всемирной организации здравоохранения (ВОЗ) или Агентстве общественного здравоохранения Канады . Эпидемиологи также могут работать в коммерческих организациях (например, фармацевтических компаниях и компаниях по производству медицинских приборов) в таких группах, как маркетинговые исследования или клинические разработки.
В статье Университета Южной Калифорнии за апрель 2020 года отмечалось, что « Эпидемия коронавируса ... выдвинула эпидемиологию — изучение заболеваемости, распространения и контроля заболеваний среди населения — на передний план научных дисциплин по всему миру и даже сделала некоторых ее специалистов временными знаменитостями» [75] .
nanlee.net