Перегруппировки, особенно те, которые могут участвовать в каскадных реакциях , такие как перегруппировки аза-Копа , имеют большое практическое и концептуальное значение в органической химии из-за их способности быстро создавать структурную сложность из простых исходных материалов. Перегруппировки аза-Копа являются примерами гетероатомных версий перегруппировки Коупа , которая представляет собой [3,3] -сигматропную перегруппировку , которая сдвигает одинарные и двойные связи между двумя аллильными компонентами. В соответствии с правилами Вудворда-Хоффмана, термические перегруппировки аза-Копа происходят супрафациально. [1] Перегруппировки аза-Копа обычно классифицируются по положению азота в молекуле (см. рисунок):

Первым примером перегруппировки аза-Копе была повсеместная катионная перегруппировка 2-аза-Копе, которая происходит при температурах на 100-200 °C ниже, чем перегруппировка Копе из-за легкого характера перегруппировки. [2] Легкость этой перегруппировки объясняется как тем фактом, что катионная 2-аза-Копе по своей природе термонейтральна, что означает отсутствие смещения для исходного материала или продукта, так и наличием заряженного гетероатома в молекуле, что снижает активационный барьер. Менее распространенными являются перегруппировка 1-аза-Копе и перегруппировка 3-аза-Копе, которые являются микроскопическими противоположностями друг друга. Перегруппировки 1- и 3-аза-Копе имеют высокие активационные барьеры и ограниченную синтетическую применимость, что объясняет их относительную неизвестность. [3] [4] [5]
Чтобы максимизировать его синтетическую полезность, катионная перегруппировка 2-аза-Копе обычно сочетается с термодинамическим смещением в одну сторону перегруппировки. Наиболее распространенная и синтетически полезная стратегия сочетает катионную перегруппировку 2-аза-Копе с циклизацией Манниха и является предметом большей части этой статьи. Эта тандемная реакция аза-Копе/Манниха характеризуется мягкими реакционными условиями, диастереоселективностью и широкой синтетической применимостью. Она обеспечивает легкий доступ к ацилзамещенным пирролидинам , структуре, обычно встречающейся в природных продуктах, таких как алкалоиды , и использовалась в синтезе ряда из них, в частности стрихнина и кринина. [6] Ларри Э. Оверман и его коллеги провели обширные исследования этой реакции. [1]

Катионная перегруппировка 2-аза-Копе, наиболее правильно называемая 2-азония-[3,3]-сигматропной перегруппировкой, была тщательно изучена Ларри Э. Оверманом и его коллегами. Это наиболее изученная из перегруппировок аза-Копе из-за мягких условий, необходимых для ее осуществления, а также из-за ее многочисленных синтетических применений, особенно в синтезе алкалоидов. Термодинамически общая перегруппировка 2-аза-Копе не имеет смещения продукта, поскольку разрываемые и образующиеся связи эквивалентны в любом направлении реакции, подобно перегруппировке Коупа. Наличие ионного гетероатома азота объясняет более легкую перегруппировку катионной перегруппировки 2-аза-Копе по сравнению с перегруппировкой Коупа. Следовательно, она часто сочетается с термодинамическим стоком для смещения продукта перегруппировки. [1]
В 1950 году Горовиц и Гейсман сообщили о первом примере перегруппировки 2-аза-Коупа, удивительном результате неудачной попытки синтезировать аминоспирт . [ 2] Это открытие определило основной механизм перегруппировки, поскольку продукт, скорее всего, был получен через азотный аналог перегруппировки Коупа. Обработка аллилбензиламина (A) муравьиной кислотой и формальдегидом приводит к аминоспирту (B). Аминоспирт превращается в имин при добавлении кислоты (C), которая подвергается катионной перегруппировке 2-аза-Коупа (D). Вода гидролизует ион иминия до амина (E). Обработка этого исходного материала только формальдегидом показала, что алкилирование аминогруппы произошло после катионной перегруппировки 2-аза-Коупа, что свидетельствует о быстрой легкости перегруппировки. [2]

Благодаря мягким условиям нагревания, в отличие от более жестких условий для чисто углеводородной перегруппировки Копа, эта гетероатомная перегруппировка Копа выдвинула гипотезу о том, что наличие положительного заряда на азоте в перегруппировке копа значительно снижает активационный барьер для перегруппировки. [2]

Перегруппировки аза-Коуп предсказываются правилами Вудворда-Хоффмана как супрафациальные. Однако, хотя это никогда явно не изучалось, Оверман и его коллеги выдвинули гипотезу, что, как и в случае с катализируемой основанием окси-Коуп перегруппировкой , заряженный атом искажает сигматропную перегруппировку с чисто согласованного механизма реакции (как и ожидалось в перегруппировке Коупа) на механизм с частичным бирадикальным/диполярным характером из-за делокализации положительного заряда на аллильный фрагмент, что ослабляет аллильную связь. Это приводит к снижению активационного барьера для разрыва связи. Таким образом, катионная-аза-Коуп перегруппировка происходит быстрее, чем более согласованные процессы, такие как перегруппировка Коупа. [6] [7]
Катионная перегруппировка 2-аза-Копе характеризуется высокой стереоспецифичностью, которая возникает из-за ее высокой предпочтительности для переходного состояния кресла . В своем исследовании стереоспецифичности этой перегруппировки Оверман и его коллеги использовали логику, похожую на классические эксперименты Деринга и Рота, [8], которые показали, что перегруппировка Коупа предпочитает конформацию кресла. [9] Используя катионную реакцию 2-аза-Копе/Манниха на предшественниках пирролизидина, они показали, что пирролизидины с цис-заместителями из E-алкенов и транс-заместителями из Z-алкенов являются в значительной степени предпочтительными, результаты, которые указывают на переходное состояние кресла. Если бы переходное состояние в ванне было действующим, были бы получены противоположные результаты (подробно на изображении ниже). [9] Как и во многих реакциях, конверсия Z-енолята обеспечивает более низкую селективность из-за 1,3-диаксиальных стерических взаимодействий между енолятом и кольцом, а также из-за того, что заместители предпочитают квазиэкваториальное расположение. Это помогает объяснить более высокие температуры, необходимые для конверсии Z-енолята. [6] [9] Переходное состояние лодки еще менее благоприятно для катионной-2-аза-Копе перегруппировки, чем для перегруппировки Копе: в ситуациях, аналогичных тем, когда перегруппировка Копе принимает переходное состояние лодки, перегруппировка аза-Копе продолжается в геометрии кресла. [1] [6] [10] Эти результаты согласуются с результатами вычислительной химии , которые далее утверждают, что переходное состояние находится под кинетическим контролем. [11]

Важно, что эти стереохимические эксперименты подразумевают, что катионная перегруппировка 2-аза-Копе (а также циклизация Манниха) происходят быстрее, чем таутомеризация енола или иминия. Если бы это было не так, то не наблюдалось бы никакой значимой стереохимии, что подчеркивает легкость этой быстрой реакции. [1]
Реакция аза-Коуп/Манниха, при участии в расширяющихся кольцах, следует стереохимии, продиктованной наиболее благоприятной конформацией кресла, которая обычно размещает объемные заместители квазиэкваториально. Виниловые и аминные компоненты могут иметь либо син-, либо анти-связи при установке на кольце. Эта связь обычно диктуется аминным заместителем: объемные заместители приводят к син-предшественникам аза-Коуп. В то время как анти-виниловые и аминные заместители обычно имеют только одно предпочтительное переходное состояние, что приводит к цис-конденсированной кольцевой системе, предпочтительный продукт син-заместителей может изменяться, продиктованным стерическими взаимодействиями с растворителями или большими N-заместителями, которые могут иметь предпочтение перед объемными заместителями и изменять переходное состояние. [12] [13]
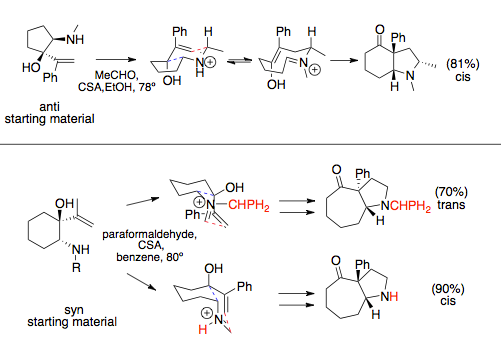
Для простых реакций аза-Коупа/Манниха, которые не участвуют в кольцевом аннелировании, а именно конденсации аминоспиртов и эфиров, вращение связей происходит быстрее, чем циклизация Манниха, и наблюдаются рацемические продукты. [14] Этого можно избежать, используя хиральный вспомогательный заместитель на амине. Реакции, привязанные к кольцам, не могут подвергаться этим вращениям связей. [1]

Первый пример Горовица и Гейсмана демонстрирует возможный термодинамический сток для сопряжения с катионной перегруппировкой 2-аза-Копе, где продукт смещен фенильным заместителем через арильное сопряжение, затем захвачен гидролизом иминиума. Другие методы смещения продукта включают использование заместителей, которые более стабильны на замещенных углеродах, освобождение кольцевого напряжения (например, путем сопряжения перегруппировки с раскрытием циклопропана), внутримолекулярное улавливание (на фото) и сопряжение перегруппировки с циклизацией Манниха. [1] [15]

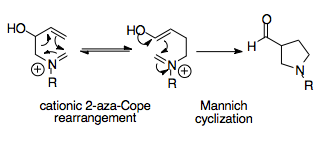
Реакция аза-Коупа/Манниха является синтетически мощной реакцией, поскольку она способна создавать сложные циклические молекулы из простых исходных материалов. Эта тандемная реакция обеспечивает термодинамический уклон в сторону одного продукта перегруппировки, поскольку циклизация Манниха необратима, а ее продукт, ацилзамещенное пирролидиновое кольцо, более стабильно, чем продукт перегруппировки. [1] [16]
Оверман и его коллеги осознали, что катионная перегруппировка 2-аза-Копе может быть потенциально синтетически мощной, если можно ввести соответствующий термодинамический сток. Их логика заключалась в том, чтобы включить нуклеофильный заместитель в исходный материал, а именно спиртовую группу, которая действует только после перегруппировки, преобразованной в енол, готовый атаковать ион иминия.
Это первое сообщение о реакции было реакцией между альдегидами и 2-алкокси-3-бутенаминами, которые образовали аминоспирт, продуктом реакции которого аза-Копе/Манниха было ацилзамещенное пирролидиновое кольцо. Эта простая процедура включала только слабое нагревание в течение нескольких часов. Примечательно, что реакция аза-Копе/Манниха происходит в одну стадию с превосходным выходом. Эта процедура легко применяется к конденсации аминоэфиров (показано ниже), где спирт был сначала метилирован. [16] После проведения реакции аза-Копе/Манниха кетон образуется путем добавления NaOH. [16] Амин в этом простом случае не может образовывать иминиевый ион из основных кетонов; последующие методы нашли способы включения кетонов в реакцию. [16] [17] Полезность этой реакции очевидна из того факта, что даже при образовании менее стабильного изомера реакция продолжается, демонстрируя ее высокую термодинамическую выгодность. [12] [17]


Общий продукт реакции может потенциально происходить через два отдельных пути: реакция аза-Копа/Манниха или циклизация аза-Принса/ перегруппировка пинакола . Эти механизмы имеют различные стереохимические свойства, которые объясняют доминирование реакции аза-Копа/Манниха. Реакция аза-Копа/Манниха заставляет каждый атом в аналоге диена [1,5] подвергаться sp 2 гибридизации, стирая стереохимию исходного материала в маркированной позиции R', в то время как перегруппировка аза-Принса/пинакола сохраняет стереохимию в маркированной позиции R', указывая на простой тест, который выявляет активный механизм. Энантиомерно чистый исходный материал в позиции «R'» должен приводить к рацемическому продукту, если доминирующим механизмом является реакция аза-Копа/Манниха, в то время как стереохимия должна сохраняться, если доминирующим механизмом является путь циклизации аза-Принса/перегруппировки пинакола. Простой эксперимент подтвердил, что продукт был рацемическим, предоставив четкое доказательство реакции аза-Коуп-Манниха как рабочего механизма. Дальнейшие эксперименты подтвердили это, используя знание того, что ион карбения, образованный в пути аза-Принс/пинакол, будет зависеть от способности его заместителя стабилизировать свой положительный заряд, тем самым изменяя реакционную способность пути. Однако было показано, что различные заместители оказывают незначительное влияние на результат реакции, снова указывая на реакцию аза-Коуп-Манниха как рабочий механизм. [14] Недавняя литература из лаборатории Шанахана поддерживает редкий путь аза-Принс/пинакол, связанный только со значительно повышенной нуклеофильностью алкена и электрофильностью иминиума. [1] [6] [18] [19]
Реакция аза-Копе/Манниха показывает высокую диастереоселективность, в целом в соответствии с результатами стереохимических экспериментов, проливающих свет на переходное состояние катионной перегруппировки 2-аза-Копе, которая следует, поскольку этот тандемный путь реакции был неотъемлемой частью этих экспериментов. Стереохимия перегруппировки немного сложнее, когда аллильные и аминные заместители установлены на кольце, и, таким образом, цис или транс друг к другу.
Исходный материал реакции аза-Копе/Манниха, аминоспирт, также можно рассматривать как связанный с перегруппировкой окси-Копе (ниже), как из-за ускорения его скорости за счет ионного участия, так и из-за аналогичной функции енольной коллапса циклизации Манниха и кето-енольной таутомеризации в перегруппировке окси-Копе. [7]

Реакция аза-Копа/Манниха часто является наиболее эффективным способом синтеза пирролидиновых колец и, таким образом, имеет ряд применений в общем синтезе природных продуктов. Благодаря своей диастереоселективности эта реакция пополнила каталог инструментов асимметричного синтеза, как видно из многочисленных примеров асимметричных алкалоидов, синтезированных с помощью этой реакции. Как мы видели в первой реакции аза-Копа/Манниха и при выяснении стереохимии реакции, реакция аза-Копа/Манниха может быть использована для образования пирролидиновых колец и пирролизидиновых колец. Она может быть использована для создания множества дополнительных кольцевых структур, полезных в синтезе, таких как индолизидиновые циклы и индольные кольца. [1] [7]
Классическим примером, демонстрирующим полезность этой реакции, является синтез стрихнина по Оверману. Стрихнин — это встречающийся в природе очень ядовитый алкалоид , встречающийся в древесных и вьющихся кустарниках рода Strychnos . Стрихнин обычно используется в качестве пестицида для мелких позвоночных. Первый полный синтез стрихнина , проведенный Р. Б. Вудвордом [20], представлял собой важный шаг в синтезе природных продуктов: до этого не было синтезировано ни одной молекулы, приближающейся к его сложности. О следующих полных синтезах сообщалось только в конце 1980-х годов с использованием аналогичных методов, а именно с использованием промежуточного продукта, доступного при деградации стрихнина. Все эти синтезы проводились в жестких условиях. Синтез Овермана обходит эти проблемы и является первым асимметричным полным синтезом стрихнина, использующим диастереоселективность и мягкие условия реакции аза-Копа/Манниха. Этап реакции аза-Копа/Манниха протекал с почти количественным выходом. Синтез Овермана, соответственно, на несколько порядков эффективнее своих предшественников. [20]

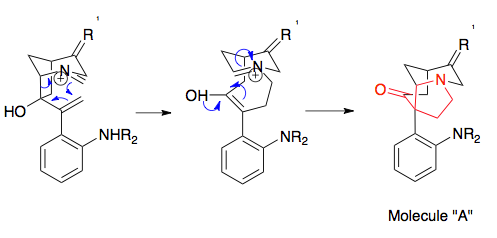
Синтез стрихнина Оверманом представляет собой полезный пример подготовки прекурсоров, необходимых для перегруппировки аза-Копа/Манниха, представляющий эффективное использование раскрытия эпоксидного кольца. Ключевые этапы синтеза субстрата перегруппировки, приводящие к исходным материалам, необходимым для реакции аза-Копа/Манниха, включали реакцию Стилла для соединения двух прекурсоров, эпоксидирование двойной связи с использованием гидропероксида трет-бутила , реакцию Виттига для преобразования кетона в алкен и этап циклизации. Алкилирование амина (не показано) преобразует молекулу в субстрат перегруппировки. Важно, что эта молекула демонстрирует энантиомерную точность реакции аза-Копа/Манниха, поскольку простой энантиомерный исходный материал диктует конечный энантиомер: энантиомер стрихнина был получен с использованием энантиомера исходного материала. [20] [21]

Синтез Овермана с подробным описанием синтеза субстрата перегруппировки, а также конечных стадий реакции подробно описан здесь: Синтез Овермана (−)-стрихнина .
Кринин — алкалоид семейства амариллисовых , и его асимметричный полный синтез был одним из первых, в котором использовалась реакция аза-копе/Манниха. Этот синтез представляет собой значительный шаг в развитии реакции аза-копе/Манниха, поскольку он использует несколько наиболее полезных синтетических стратегий, характерных для этой реакции. Эта реакция использует преимущества высокой диастереоселективности катионной-2-аза-копе перегруппировки, а также использование цианометильной группы для защиты амина во время добавления виниллития и в качестве уходящей группы для содействия образованию иминия с помощью добавления нитрата серебра. [22] Этот синтез является одним из примеров многих цианометильных групп, обеспечивающих синтетически полезный путь к образованию пирролидина и индолизидина.

Оверман и его коллеги разработали методы синтеза сложных мостиковых трициклических структур с использованием реакции аза-Копа/Манниха. Эти аза-трициклические структуры встречаются в сложном семействе алкалоидов Stemona , а также в потенциальных препаратах, таких как некоторые иммунодепрессанты. Показанный пример представляет собой простую реакцию, объединяющую исходный материал соли 1-аза-бицикло[2.2.1]гептана с параформальдегидом при 80 °C для образования основной аза-трициклической структуры молекул алкалоидов Stemona . Примечательно, что, несмотря на неблагоприятное перекрытие орбиталей из-за стерических свойств этой кольцевой системы, реакция протекает с выходом 94%, что подчеркивает силу этой реакции даже в неблагоприятных условиях. [23]
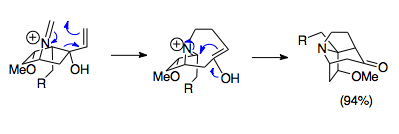

Реакция аза-Копа/Манниха, в сочетании с существующими циклами колец, часто используется для создания циклов индолизидина (пирролидин, соединенный с циклогексановым кольцом). Это типичное кольцевое аннелирование , где циклопентановый фрагмент открывается с перегруппировкой и закрывается с циклизацией Манниха, образуя шестичленное кольцо, присоединенное к пирролидиновому кольцу, в то время как наиболее популярное аза-Копа/Манниха аннелирование не является единственным. Семичленные циклы колец также можно синтезировать, поскольку ионы енола и иминия находятся достаточно близко друг к другу, чтобы подвергнуться циклизации Манниха. [22] Синтез макроциклов с использованием этой реакции не был описан из-за отсутствия близости между енолом и иминием. [6] Винилоксазолидины также могут быть использованы в качестве субстратов перегруппировки. Эта перегруппировка сначала создает винилоксазолидин из-за атаки циклогексанона аминобутенолом, который затем подвергается реакции аза-Коупа/Манниха с использованием тепла и кислоты (Льюиса или протонной). Этот пример разрушает, а затем образует пятичленное кольцо. Более сложные примеры присоединяют оксазолидин к другому кольцу, представляя дополнительные методы для образования индолизиновых циклов. [24]
Реакция аза-Коупа/Манниха имеет многочисленные преимущества по сравнению с другими методами. Мягкие условия реакции не соответствуют: легкое нагревание, обычно не выше 80 °C, широкий спектр растворителей и добавление 1 стехиометрического эквивалента кислоты, обычно камфорсульфоновой кислоты (CSA) или кислоты Льюиса. Другие пути к синтезу пирролидина не могут конкурировать со стереоспецифичностью, широкомасштабным применением в структурах, содержащих производные пирролидина, и большим спектром возможных исходных материалов. Реакция демонстрирует высокую диастереоселективность и является надежной, протекая даже при столкновении с плохим орбитальным перекрытием в переходном состоянии. [1]

Преимущества реакции аза-Коупа/Манниха мотивировали исследования по синтезу исходных материалов для реакции, которые разделились на две основные категории: присоединение амина и образование иминия (красный) и установка винилового заместителя (синий). В реакции может использоваться широкий спектр N-заместителей (R), алкильных и арильных, некоторые из которых влияют на стереохимический результат реакции. Виниловые группы, как правило, ограничиваются теми, которые являются либо 1,1-, либо 1,2-дизамещенными (винил с заместителями при R 1 и R 1 ,R 2 соответственно), с широким диапазоном допустимого электронного и стерического разнообразия. [1]
Кольцевое напряжение эпоксидов обеспечивает полезную методологию для установки аминогруппы на расстоянии двух атомов от спиртовой группы. Эпоксид может быть сначала разрушен нуклеофильной атакой бромида. Первичные амины, ароматические амины или анилиды лития также могут быть использованы в качестве нуклеофилов. Защитное O-метилирование часто следует за этим шагом и протекает легко.

Когда стерические условия допускают атаку только на соответствующий углерод (конечный углерод, а не второй углерод), эффективна прямая атака внутримолекулярным азотом, как в случае синтеза стрихнина. [16] [25]
Наиболее распространенным способом получения иминиевого иона из установленного амина является добавление формальдегида или параформальдегида, которые подвергаются кислотно-катализируемой конденсации с образованием иминиевого. Синтез стрихнина Овермана является типичным примером этого метода. [6] [25] Иногда используются внутримолекулярные карбонилы. [9] Другие методы образования иминиевого иона включают использование цианометильных групп или использование оксазолидинов в качестве предшественников карбонила.

Алкилирование аминов представляет собой распространенный метод получения предшественников иминов. Алкилирование аминов прямой реакцией S N 2 лишь изредка полезно при получении исходных материалов из-за высокой склонности аминов к сверхалкилированию. [25] Восстановительное аминирование является более распространенной и эффективной процедурой алкилирования, типичным примером которой является первая перегруппировка аза-Коупа. [16] [26] [27] Наиболее полезным и стандартным методом алкилирования аминов является образование амидной связи амином и ее последующее восстановление, часто с помощью алюмогидрида лития . [9]
Кетоны и стерически затрудненные альдегиды не подходят для основной реакции аза-Копе/Манниха, поскольку амин не может образовать с ними ион иминия. Дегидратационное образование оксазолина с последующим нагреванием в присутствии полного эквивалента кислоты представляет собой способ обойти эту проблему. Оверман сообщил об использовании оксизолидинов для получения иминиевого иона, необходимого для реакции. После образования Оверман показал, что циклогексаноны могут быть использованы для карбонильного компонента в синтезе пирролидина. [17] Эта реакция протекала с различными формами циклогексанонов. Когда был заменен ациклический кетон, реакция протекала с низким выходом, подчеркивая термодинамическую выгодность высвобождения циклогексанона из карбонила с двойной связью, поскольку это создает неблагоприятное напряжение связи в конформации кресла. Это представляет собой одну из наиболее удобных конструкций кольцевой системы 1-азаспиро[4,5]декана, полезного природного продукта. [17]
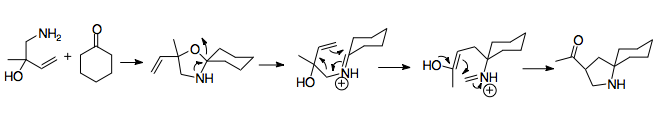
Винилирование может предложить дополнительные синтетические преимущества, позволяя расширить функциональность реакции. [23] Обычно используются литийорганические реагенты . Часто заместитель или защитная группа добавляются к азоту, хотя это не всегда необходимо. Добавление лития к реакции оказывает большое влияние на стереохимию исходного материала, поскольку азот координируется с ним. Исходные материалы, затронутые этой координацией, обычно приводят к анти-аза-копе-предшественникам, в то время как те, которые не являются таковыми, например, содержащие высокозамещенные, стерически затрудненные амины, приводят к син-предшественникам. Таким образом, природа заместителя азота имеет большое значение. [6] [25]
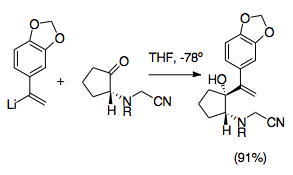
Цианометильные группы представляют собой простой способ защиты иминий-иона во время аллильного винилирования кетона. Цианамидные группы и аналоги часто использовались при генерации иминий-ионов. Обычно они устанавливаются путем нуклеофильного присоединения к иминий-иону, обычно получаемому путем алкилирования амина формальдегидом. Таким образом, иминий-ион маскируется. [28] Из этого следует, что использование цианометильной группы обеспечивает эффективный способ управления реакцией аза-Коупа/Манниха. Цианометильная группа защищает азот в положении 2 во время образования другого аллильного аналога по логике, аналогичной умполунгу цианидного типа . Затем она позже обеспечивает хорошую уходящую группу для образования иминий-иона в соответствии с ее использованием при генерации иминий-иона. [29] Генерация иминий-иона из цианометильных групп обычно стимулируется добавлением нитрата серебра, хотя использовались и другие соединения серебра и меди. Этот дополнительный шаг позволяет более точно контролировать генерацию иминиевых ионов. [6] [29] Важно, что эти подготовительные реакции должны проводиться при -78 °C, чтобы предотвратить взаимодействие цианометила/виниллития. Этот метод также допускает множество различных возможных N-заместителей и может быть использован для упрощения синтеза октагидроиндолов и пирролов . [1] [29]


Перегруппировки 1- и 3-аза-Копэ не столь очевидны по сравнению с катионной перегруппировкой 2-аза-Копэ из-за их энергий активации, которые сравнительно намного выше, чем у катионной перегруппировки 2-аза-Копэ.
1- и 3-аза-Коп имеют тенденцию к образованию имина, а не енамина, поскольку π-связь углерода-азота сильнее, чем σ-связь углерода-азота, что означает, что перегруппировка 3-аза-Коп является термодинамически выгодной, в то время как перегруппировка 1-аза-Коп не является таковой: имин имеет почти на 10 ккал/моль меньше энергии. Таким образом, большие активационные барьеры 3-аза-Коп основаны на кинетике. Исследования перегруппировок как 1, так и 3-аза-Коп были сосредоточены на поиске хороших движущих сил для снижения активационных барьеров. Несколько версий этих перегруппировок были оптимизированы для синтетической полезности. Перегруппировка 1-аза-Коп обычно сопряжена с термодинамическими движущими силами. Перегруппировки 3-аза-Коп обычно выполняются катионно, чтобы снизить кинетический барьер для его термодинамически выгодного продукта. [30]
Эти перегруппировки следуют большей части механистической логики катионной перегруппировки 2-аза-копе. Перегруппировки 1- и 3-аза-копе происходят преимущественно через переходные состояния кресла (и сохраняют стереохимию, аналогично катионной перегруппировке 2-аза-копе) и ускоряются при введении положительного заряда, поскольку это придает переходному состоянию более бирадикальный/диполярный характер. [30] Ожидается, что перегруппировка 3-аза-копе (и, следовательно, также перегруппировка 1-аза-копе, которая проходит через то же переходное состояние) проявит еще меньший ароматический характер в своем переходном состоянии по сравнению с перегруппировкой Копе и катионной перегруппировкой 2-аза-копе, что способствует более высоким требуемым температурам (близким к температурам, необходимым для перегруппировки Копе, иногда даже выше, от 170 до 300 градусов) для преодоления кинетических активационных барьеров для этих расположений. [3] [30] [31]

Реакция 3-аза-Копе была открыта вскоре после того, как была идентифицирована перегруппировка 2-аза-Копе, из-за ее аналогичной связи с перегруппировкой Кляйзена. Действительно, в ранних работах эта версия перегруппировки аза-Копе часто упоминается как перегруппировка амино-Кляйзена, что является неверным представлением перегруппировки, поскольку это означало бы, что в молекуле присутствуют как азот, так и кислород. [3] Эта перегруппировка может быть использована для образования гетероциклических колец с участием углерода, чаще всего пиперидина.
Один из первых примеров такого расположения был выявлен Берпиттом, который распознал перегруппировку, происходящую в солях аммония, которые из-за своей заряженной природы протекали экзотермически без добавления тепла — что важно, без тетразамещенного азота перегруппировка не происходила. [32] Следуя этой логике, большая часть исследований перегруппировки 3-аза-Копе была сосредоточена на заряженных цвиттер-ионных версиях этой реакции, поскольку распределение заряда помогает снизить активационный барьер: в некоторых случаях перегруппировка может происходить при температурах до -20 °C. [33]

Хилл и Гилман впервые сообщили об общей незаряженной перегруппировке 3-аза-Коуп в 1967 году. После создания соответствующим образом замещенных енаминов, интенсивное нагревание дало почти полную перегруппировку в иминный продукт. Однако этот путь перегруппировки имеет ограниченную полезность. [34]

Первая обнаруженная реакция 1-аза-Копе была простым аналогом общей реакции Коупа и требовала интенсивного нагрева для преодоления ее большого термодинамического активационного барьера; большинство последующих работ по перегруппировке 1-аза-Копе были, таким образом, сосредоточены на сопряжении расположения с движущей термодинамической силой, чтобы избежать этих жестких условий реакции. Было высказано предположение, что переходное состояние, определяющее скорость перегруппировки 1-аза-Копе, имеет частичный бирадикальный и диполярный характер переходного состояния из-за присутствия гетероатома. [4]
Фаулер и его коллеги придумали схему, которая мобилизует перегруппировку 1-аза-Копе в качестве синтетически полезного пути. [3] Фаулер и его коллеги поняли, что поскольку барьер для реакции заключается в термодинамическом предпочтении азота оставаться в виде имина, стабилизация азота может иметь термодинамически выгодный эффект. С этой целью Фаулер и его коллеги установили карбонильную группу на азоте, предположив, что неподеленная пара азота будет стабилизирована за счет участия в амидной связи, и что электроотрицательность этой амидной группы снизит НСМО иминной группы, сделав переходное состояние более благоприятным. [3] Используя эту стратегию, Фаулер и его коллеги смогли использовать перегруппировку 1-аза-Копе для создания производных пиперидина и пиридина . Было показано, что эта стратегия является относительно надежной, позволяя образовывать продукты даже при принудительном прохождении через переходное состояние в ванне, при возмущении эффектами заместителей или при конкуренции с альтернативными перегруппировками. [3] Также существенным является относительная простота получения реагентов, которая использует реакцию Дильса-Альдера в сочетании с относительно простыми этапами обработки, что позволяет проводить синтезы с использованием сложного цикла. [3]

Другие методы преодоления этого термодинамического барьера включают его сопряжение с деформацией циклопропанового кольца, что позволяет реакции протекать при гораздо более низких температурах. [35]
