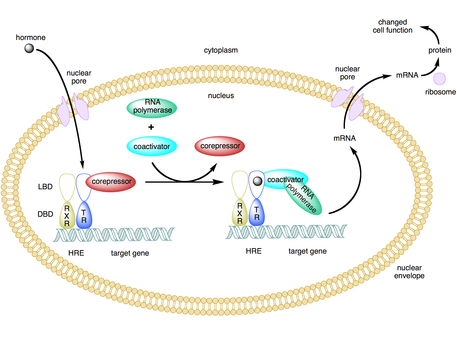
Коактиватор — это тип транскрипционного корегулятора , который связывается с активатором ( фактором транскрипции ) для увеличения скорости транскрипции гена или набора генов. [1] Активатор содержит домен связывания ДНК , который связывается либо с участком промотора ДНК , либо со специфической регуляторной последовательностью ДНК, называемой энхансером . [2] [3] Связывание комплекса активатор-коактиватор увеличивает скорость транскрипции путем привлечения общего механизма транскрипции к промотору, тем самым увеличивая экспрессию генов . [3] [4] [5] Использование активаторов и коактиваторов обеспечивает высокоспецифичную экспрессию определенных генов в зависимости от типа клеток и стадии развития. [2]
Некоторые коактиваторы также обладают активностью ацетилтрансферазы гистонов (HAT). HAT образуют большие мультипротеиновые комплексы, которые ослабляют связь гистонов с ДНК путем ацетилирования N -концевого хвоста гистонов. Это обеспечивает больше места для транскрипционного аппарата для связывания с промотором, тем самым увеличивая экспрессию генов. [1] [4]
Активаторы встречаются во всех живых организмах , но белки-коактиваторы обычно встречаются только у эукариот, поскольку они более сложны и требуют более сложного механизма для регуляции генов. [1] [4] У эукариот коактиваторы обычно представляют собой белки, локализованные в ядре. [1] [6]

Некоторые коактиваторы косвенно регулируют экспрессию генов, связываясь с активатором и вызывая конформационные изменения , которые затем позволяют активатору связываться с энхансером ДНК или последовательностью промотора. [2] [7] [8] После того, как комплекс активатор-коактиватор связывается с энхансером, РНК-полимераза II и другие общие механизмы транскрипции подключаются к ДНК, и начинается транскрипция. [9]
Ядерная ДНК обычно плотно обмотана вокруг гистонов, что затрудняет или делает невозможным доступ транскрипционного аппарата к ДНК. Эта связь обусловлена в первую очередь электростатическим притяжением между ДНК и гистонами, поскольку фосфатный остов ДНК заряжен отрицательно, а гистоны богаты остатками лизина, которые заряжены положительно. [10] Тесная ассоциация ДНК-гистон предотвращает транскрипцию ДНК в РНК.
Многие коактиваторы обладают активностью ацетилтрансферазы гистонов (HAT), что означает, что они могут ацетилировать определенные остатки лизина на N-концевых хвостах гистонов. [4] [7] [11] В этом методе активатор связывается с сайтом энхансера и привлекает комплекс HAT, который затем ацетилирует гистоны, связанные с нуклеосомным промотором, нейтрализуя положительно заряженные остатки лизина. [7] [11] Эта нейтрализация заряда приводит к тому, что гистоны имеют более слабую связь с отрицательно заряженной ДНК, что ослабляет структуру хроматина, позволяя другим факторам транскрипции или транскрипционным аппаратам связываться с промотором (инициация транскрипции). [4] [11] Ацетилирование комплексами HAT также может помочь сохранить хроматин открытым в течение всего процесса удлинения, увеличивая скорость транскрипции. [4]

Ацетилирование N-концевого гистонового хвоста является одной из наиболее распространенных модификаций белков, обнаруженных у эукариот, при этом около 85% всех человеческих белков ацетилированы. [12] Ацетилирование имеет решающее значение для синтеза, стабильности, функционирования, регуляции и локализации белков и транскриптов РНК. [11] [12]
HAT функционируют аналогично N-концевым ацетилтрансферазам (NAT), но их ацетилирование обратимо в отличие от NAT. [13] Ацетилирование гистонов, опосредованное HAT, обращается с помощью гистондеацетилазы (HDAC), которая катализирует гидролиз остатков лизина, удаляя ацетильную группу из гистонов. [4] [7] [11] Это заставляет хроматин снова закрыться из своего расслабленного состояния, что затрудняет связывание транскрипционного аппарата с промотором, тем самым подавляя экспрессию генов. [4] [7]
Примерами коактиваторов, которые проявляют активность HAT, являются CARM1 , CBP и EP300 . [14] [15]
Многие коактиваторы также функционируют как корепрессоры при определенных обстоятельствах. [5] [9] Кофакторы, такие как TAF1 и BTAF1, могут инициировать транскрипцию в присутствии активатора (действовать как коактиватор) и подавлять базальную транскрипцию в отсутствие активатора (действовать как корепрессор). [9]
Регуляция транскрипции является одним из наиболее распространенных способов изменения экспрессии генов организмом. [16] Использование активации и коактивации позволяет лучше контролировать, когда, где и сколько белка производится. [1] [7] [16] Это позволяет каждой клетке быстро реагировать на изменения окружающей среды или физиологические изменения и помогает смягчить любой ущерб, который может возникнуть, если бы он не регулировался иным образом. [1] [7]
Мутации в генах-коактиваторах, приводящие к потере или приобретению функции белка, были связаны с такими заболеваниями и расстройствами, как врожденные дефекты , рак (особенно гормонально-зависимые виды рака), нарушения развития нервной системы и умственная отсталость (ID), среди многих других. [17] [5] Нарушение регуляции, приводящее к чрезмерной или недостаточной экспрессии коактиваторов, может пагубно взаимодействовать со многими лекарственными средствами (особенно антигормональными препаратами) и было связано с раком, проблемами фертильности , а также расстройствами развития нервной системы и нейропсихиатрическими расстройствами . [5] В качестве конкретного примера, нарушение регуляции белка, связывающего CREB (CBP), который действует как коактиватор для многочисленных факторов транскрипции в центральной нервной системе (ЦНС), репродуктивной системе, тимусе и почках, было связано с болезнью Хантингтона , лейкемией , синдромом Рубинштейна-Тейби , нарушениями развития нервной системы и дефицитом иммунной системы , кроветворения и функции скелетных мышц . [14] [18]
Коактиваторы являются многообещающими целями для лекарственной терапии при лечении рака, метаболических расстройств , сердечно-сосудистых заболеваний и диабета 2 типа , а также многих других расстройств. [5] [19] Например, коактиватор стероидных рецепторов (SCR) NCOA3 часто сверхэкспрессируется при раке молочной железы , поэтому разработка молекулы-ингибитора, которая нацелена на этот коактиватор и снижает его экспрессию, может быть использована в качестве потенциального лечения рака молочной железы. [15] [20]
Поскольку факторы транскрипции контролируют множество различных биологических процессов, они являются идеальными мишенями для лекарственной терапии. [14] [21] Коактиваторы, которые их регулируют, можно легко заменить синтетическим лигандом, который позволяет контролировать увеличение или уменьшение экспрессии генов. [14]
Дальнейшие технологические достижения предоставят новые знания о функции и регуляции коактиваторов на уровне всего организма и прояснят их роль в заболеваниях человека, что, как мы надеемся, обеспечит лучшие цели для будущей лекарственной терапии. [14] [15]
На сегодняшний день известно более 300 корегуляторов. [15] Вот некоторые примеры таких коактиваторов: [22]