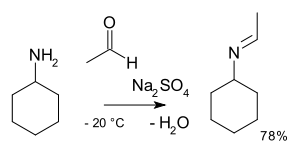
В органической химии алкилимино -де-оксо-бисубституция — это органическая реакция карбонильных соединений с аминами в имины . [2] Название реакции основано на Номенклатуре превращений ИЮПАК . Реакция катализируется кислотой , а тип реакции — нуклеофильное присоединение амина к карбонильному соединению с последующим переносом протона от азота к кислороду в стабильный полуаминаль или карбиноламин. С первичными аминами вода теряется в реакции элиминирования в имин . С ариламинами образуются особенно стабильные основания Шиффа .
Стадии реакции являются обратимыми реакциями , и реакция доводится до конца путем удаления воды, например, с помощью азеотропной перегонки , молекулярных сит или тетрахлорида титана . Первичные амины реагируют через нестабильное полуаминное промежуточное соединение, которое затем отщепляет воду.
Вторичные амины не теряют воду легко, поскольку у них нет доступного протона, и вместо этого они часто реагируют далее с образованием аминаля :
или когда α-карбонильный протон присутствует в енамин :
В кислой среде продуктом реакции является соль иминия, образующаяся за счет потери воды.
Этот тип реакции встречается во многих гетероциклических препаратах, например, в реакции Поварова и синтезе Фридлендера с получением хинолинов .
Соединения, содержащие как первичную, так и вторичную аминовую и карбонильную функциональную группу, часто являются лабильными. Это руководство применимо к аминоальдегидам, аминокетонам и аминоэфирам; действительно, молекула не может одновременно нести ( незащищенные ) альдегидные и аминные группы. Аминоацетон , простейший аминокетон, не может быть выделен в виде жидкости или твердого вещества, [3] а 2-аминобензальдегид олигомеризуется в растворе или в расплаве. [4] α - формилазиридин , восстановленный с помощью DIBAL из эфира , обратимо [Примечание 1] димеризуется в [Примечание 2] оксазолидин : [5]

Гидразины и гидроксиламины вытесняют карбонильные кислороды гораздо легче, чем амины. Их равновесия сильно благоприятствуют дегидратированному продукту, и карбонил восстанавливается с трудом. [6]