α 2 -Макроглобулин ( α 2 M ) или альфа-2-макроглобулин — это большой (720 кДа) плазменный белок, содержащийся в крови . Он в основном вырабатывается печенью , а также локально синтезируется макрофагами , фибробластами и адренокортикальными клетками . У человека он кодируется геном A2M .
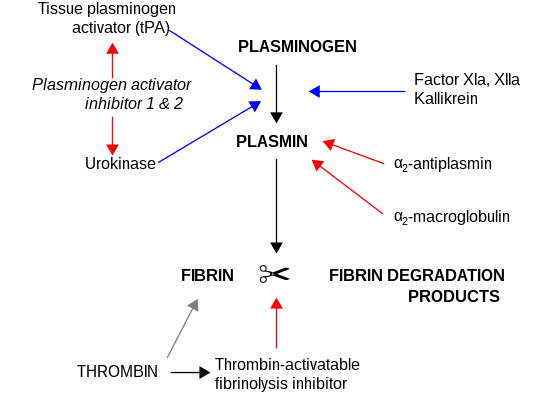
α 2 -макроглобулин действует как антипротеаза и способен инактивировать огромное количество протеиназ. Он действует как ингибитор фибринолиза, ингибируя плазмин и калликреин . Он действует как ингибитор коагуляции, ингибируя тромбин . α 2 -макроглобулин может действовать как белок-носитель, поскольку он также связывается с многочисленными факторами роста и цитокинами, такими как тромбоцитарный фактор роста, основной фактор роста фибробластов, TGF-β, инсулин и IL-1β.
Не было выявлено никакого специфического дефицита с сопутствующим заболеванием, и ни одно болезненное состояние не приписывается низким концентрациям α 2 -макроглобулина. Концентрация α 2 -макроглобулина возрастает в 10 раз и более при нефротическом синдроме, когда другие низкомолекулярные белки теряются в моче. Потеря α 2 -макроглобулина в мочу предотвращается его большим размером. Конечным результатом является то, что α 2 -макроглобулин достигает уровней сыворотки, равных или превышающих уровни альбумина при нефротическом синдроме, что имеет эффект поддержания онкотического давления .
Человеческий α 2 -макроглобулин состоит из четырех идентичных субъединиц, соединенных вместе связями -SS- . [5] [6] В дополнение к тетрамерным формам α 2 -макроглобулина были идентифицированы димерные , а позднее и мономерные ингибиторы αM-протеазы. [7] [8]
Каждый мономер человеческого α 2 -макроглобулина состоит из нескольких функциональных доменов, включая домены макроглобулина, домен, содержащий тиоловый эфир, и домен, связывающий рецептор. [9] В целом, α 2 -макроглобулин является крупнейшим основным неиммуноглобулиновым белком в плазме человека.
Было показано, что аминокислотная последовательность α2 - макроглобулина на 71% совпадает с аминокислотной последовательностью белка зоны беременности (PZP; также известного как связанный с беременностью α2 - гликопротеин). [10]
Семейство белков α-макроглобулина (αM) включает ингибиторы протеазы [11], типичным представителем которых является человеческий тетрамерный α 2 -макроглобулин (α 2 M); они принадлежат к семейству ингибиторов протеиназы MEROPS I39, клан IL. Эти ингибиторы протеазы обладают несколькими определяющими свойствами, в том числе (1) способностью ингибировать протеазы всех каталитических классов, (2) наличием «области приманки» (также известной как последовательность аминокислот в молекуле α 2 -макроглобулина или гомологичного белка, которая содержит разрезаемые пептидные связи для тех протеиназ, которые она ингибирует) и тиолового эфира, (3) аналогичным механизмом ингибирования протеазы и (4) инактивацией ингибирующей способности путем реакции тиолового эфира с небольшими первичными аминами . Ингибиторы протеазы αM ингибируют стерическими препятствиями. [12] Механизм включает расщепление протеазой области приманки, сегмента αM, который особенно восприимчив к протеолитическому расщеплению, которое инициирует конформационное изменение , так что αM разрушается вокруг протеазы. В полученном комплексе αM-протеаза активный сайт протеазы стерически экранирован, таким образом существенно уменьшая доступ к белковым субстратам . Два дополнительных события происходят в результате расщепления области приманки, а именно (1) h-цистеинил-g-глутамил тиоловый эфир становится высокореактивным и (2) крупное конформационное изменение обнажает консервативный домен связывания COOH-терминала рецептора [13] (RBD). Воздействие RBD позволяет комплексу αM-протеазы связываться с рецепторами клиренса и удаляться из циркуляции. [14] Были идентифицированы тетрамерные, димерные и, совсем недавно, мономерные ингибиторы αM-протеазы. [7] [8]
α 2 -Макроглобулин способен инактивировать огромное количество протеиназ (включая сериновые , цистеиновые , аспарагиновые и металлопротеиназы ). Он действует как ингибитор фибринолиза , ингибируя плазмин и калликреин. Он действует как ингибитор коагуляции , ингибируя тромбин . [15] α 2 -Макроглобулин имеет в своей структуре область «приманки» из 35 аминокислот. Протеиназы, связывающиеся и расщепляющие область приманки, становятся связанными с α 2 M. Комплекс протеиназа–α 2 M распознается рецепторами макрофагов и выводится из системы.
Известно, что α 2 -макроглобулин связывает цинк , а также медь в плазме, даже сильнее, чем альбумин, и поэтому его также называют транскупреином . [16] От 10 до 15% меди в плазме человека хелатируется α 2 -макроглобулином. [17]
Уровень α 2 -макроглобулина повышается, когда уровень сывороточного альбумина низкий, [18] , что чаще всего наблюдается при нефротическом синдроме , состоянии, при котором почки начинают выводить некоторые из более мелких белков крови. Из-за своего размера α 2 -макроглобулин задерживается в кровотоке. Увеличение продукции всех белков означает, что концентрация α 2 -макроглобулина увеличивается. Это увеличение не оказывает существенного неблагоприятного воздействия на здоровье, но используется в качестве диагностического признака.
Увеличение α2 - макроглобулина при нормальном количестве альбумина в основном указывает на острое и/или хроническое воспаление. [19]
Распространенный вариант (29,5%) ( полиморфизм ) α2 - макроглобулина приводит к повышенному риску болезни Альцгеймера . [20] [21]
α2 - макроглобулин связывается с активными формами желатиназы ( ММП -2 и ММП-9 ) и удаляет их из кровотока через рецепторы-мусорщики на фагоцитах.