В органической химии арилгалогенид (также известный как галогенарен ) представляет собой ароматическое соединение , в котором один или несколько атомов водорода, непосредственно связанных с ароматическим кольцом, замещены галогенидом . Галогенарены отличаются от галогеналканов , поскольку они демонстрируют множество различий в методах получения и свойствах. Наиболее важными членами являются арилхлориды, но класс соединений настолько широк, что существует множество производных и применений.
Арилфториды используются в качестве синтетических промежуточных продуктов, например, для приготовления фармацевтических препаратов, пестицидов и жидких кристаллов. [1] Превращение солей диазония является хорошо известным путем к арилфторидам. Таким образом, анилины являются предшественниками арилфторидов. В классической реакции Шимана тетрафторборат является донором фторида:
В некоторых случаях используют фторидную соль:
Многие коммерческие арилфториды производятся из арилхлоридов с помощью процесса Halex . Этот метод часто используется для арилхлоридов, также содержащих электроноакцепторные группы . Показательным является синтез 2-фторнитробензола из 2-нитрохлорбензола : [2]
Арилхлориды — это арилгалогениды, производимые в самых крупных коммерческих масштабах: 150 000 тонн/год только в США (1994). Уровень производства снижается из-за экологических проблем. Хлорбензолы используются в основном как растворители. [3]
Галогенирование Фриделя-Крафтса или «прямое хлорирование» является основным путем синтеза. Кислоты Льюиса , например, хлорид железа(III) , катализируют реакции. Наиболее распространенный арилгалогенид, хлорбензол , производится этим путем: [4]
Монохлорирование бензола сопровождается образованием производных дихлорбензола . [3] Арены с электронодонорными группами реагируют с галогенами даже в отсутствие кислот Льюиса. Например, фенолы и анилины быстро реагируют с хлором и бромной водой, давая многогалогенированные продукты. Доступно множество подробных лабораторных процедур. [5] Для производных алкилбензола, например, толуола , алкильные позиции имеют тенденцию галогенироваться в условиях свободных радикалов , тогда как галогенирование кольца благоприятствует при наличии кислот Льюиса. [6] Обесцвечивание бромной воды богатыми электронами аренами используется в тесте на бром .
Оксихлорирование бензола было хорошо изучено, что обусловлено необходимостью исключения HCl как побочного продукта при прямом галогенировании: [ 3]
Однако эта технология не получила широкого распространения.
Реакция Гаттермана может также использоваться для преобразования солей диазония в хлорбензолы с использованием реагентов на основе меди. Из-за высокой стоимости солей диазония этот метод зарезервирован для специальных хлоридов.
Основные арилбромиды, производимые в коммерческих целях, — это тетрабромфталевый ангидрид, декабромдифениловый эфир и тетрабромбисфенол-А . Эти материалы используются в качестве антипиренов . Их получают прямым бромированием фенолов и ариловых эфиров. Фталевый ангидрид плохо реагирует с бромом, что требует использования кислых сред.
Реакция Гаттермана может также использоваться для преобразования солей диазония в бромбензолы с использованием реагентов на основе меди. Из-за высокой стоимости солей диазония этот метод зарезервирован для специальных бромидов.
Синтетические арилиодиды используются в качестве рентгеноконтрастных агентов , но в остальном эти соединения не производятся в больших масштабах. Арилиодиды являются «легкими» субстратами для многих реакций, таких как реакции кросс-сочетания и превращения в реактивы Гриньяра , но они намного дороже, чем более легкие, менее реакционноспособные арилхлориды и бромиды.
Арилиодиды можно получить путем обработки солей диазония солями иодида. [7] Электроно-богатые арены, такие как анилины и диметоксипроизводные, реагируют непосредственно с иодом. [8]
Ариллитий и арильные реагенты Гриньяра реагируют с иодом, образуя арилгалогенид:
Этот метод применим к получению всех арилгалогенидов. Одним из ограничений является то, что большинство, но не все [9] ариллитиевые реагенты и реактивы Гриньяра производятся из арилгалогенидов.
Хотя термин арилгалогенид включает галогенированные производные любого ароматического соединения, он обычно относится к галогенбензолам, которые являются конкретно галогенированными производными бензола . Группы галогенбензолов включают фторбензолы , хлорбензолы , бромбензолы и иодбензолы , а также смешанные галогенбензолы, содержащие по крайней мере два различных типа галогенов, связанных с одним и тем же бензольным кольцом. Существует также много производных галогенбензола .
Галопиридины основаны на ароматическом соединении пиридин . [10] Сюда входят хлорпиридины и бромпиридины . Хлорпиридины являются важными промежуточными продуктами для фармацевтических препаратов и агрохимикатов .
Галогенированные нафталины основаны на нафталине . Полихлорированные нафталины широко использовались с 1930-х по 1950-е годы в производстве кабелей и конденсаторов из-за их изоляционных, гидрофобных и огнестойких свойств, но с тех пор их использование в этом качестве было прекращено из-за токсичности, стойкости к воздействию окружающей среды и появления новых материалов. [3]
Гормоны щитовидной железы трийодтиронин (Т3 ) и тироксин (Т4 ) являются арилиодидами. Тетрайодид, Т4, биосинтезируется электрофильным иодированием производного тирозина. [11] Синтетический Т4 является одним из наиболее часто назначаемых лекарств в США [12]
Многие хлорированные и бромированные ароматические соединения производятся морскими организмами. Хлорид и бромид в океанских водах являются источником галогенов. Различные ферменты пероксидазы (например, бромпероксидаза ) катализируют реакции. Многочисленны производные электронно-богатых колец, обнаруженных в тирозине, триптофане и различных пирролах. Некоторые из этих природных арилгалогенидов проявляют полезные лечебные свойства. [13] [14]


Расстояния CX для арилгалогенидов следуют ожидаемой тенденции. Эти расстояния для фторбензола, хлорбензола, бромбензола и метил 4-иодбензоата составляют 135,6(4), 173,90(23), 189,8(1) и 209,9 пм соответственно. [15]
В отличие от типичных алкилгалогенидов, арилгалогениды обычно не участвуют в обычных реакциях замещения. Арилгалогениды с электроноакцепторными группами в орто- и пара -положениях могут подвергаться реакциям S N Ar . Например, 2,4-динитрохлорбензол реагирует в щелочном растворе с образованием фенола.
В отличие от большинства других реакций замещения, фторид является лучшей уходящей группой, а иодид — наихудшей. [16] В статье 2018 года указывается, что эта ситуация на самом деле может быть довольно распространенной, встречаясь в системах, которые, как ранее предполагалось, протекают по механизмам S N Ar. [17]
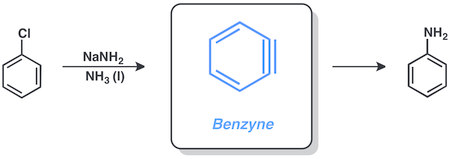
Арилгалогениды часто реагируют через посредство бензолов . Хлорбензол и амид натрия реагируют в жидком аммиаке, давая анилин по этому пути.
Арилгалогениды реагируют с металлами, обычно литием или магнием , давая металлоорганические производные, которые действуют как источники арильных анионов. В результате реакции обмена металл-галоген арилгалогениды превращаются в ариллитиевые соединения. Показательным является получение фениллития из бромбензола с использованием н -бутиллития ( н -BuLi):
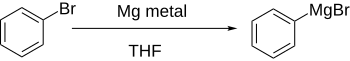
Прямое образование реактивов Гриньяра путем добавления магния к арилгалогениду в эфирном растворе работает хорошо, если ароматическое кольцо не дезактивировано в значительной степени электроноакцепторными группами.
Галогениды могут быть замещены сильными нуклеофилами через реакции с участием радикальных анионов. Альтернативно, арилгалогениды, особенно бромиды и иодиды, подвергаются окислительному присоединению и, таким образом, подвергаются реакциям аминирования Бухвальда-Хартвига .
Хлорбензол когда-то был предшественником фенола , который теперь производится путем окисления кумола . При высоких температурах арильные группы реагируют с аммиаком, давая анилины. [3]
Rhodococcus phenolicus — это бактерия, которая расщепляет дихлорбензол как единственный источник углерода. [18]
Арилгалогениды, производимые в наибольшем масштабе, — это хлорбензол и изомеры дихлорбензола. Одним из основных, но прекращенных применений было использование хлорбензола в качестве растворителя для диспергирования гербицида Лассо. В целом, производство арилхлоридов (также производных нафтила) снижается с 1980-х годов, отчасти из-за экологических проблем. [3] Трифенилфосфин производится из хлорбензола:
Арилбромиды широко используются в качестве антипиренов. Наиболее заметным членом является тетрабромбисфенол-А , который получают прямым бромированием дифенола. [19]