Нуклеофильное ароматическое замещение ( SNAr ) — это реакция замещения в органической химии , в которой нуклеофил замещает хорошую уходящую группу , например галогенид , на ароматическом кольце . Ароматические кольца обычно нуклеофильны, но некоторые ароматические соединения подвергаются нуклеофильному замещению. Так же, как обычно нуклеофильные алкены могут подвергаться сопряженному замещению, если они несут электроноакцепторные заместители, так и обычно нуклеофильные ароматические кольца также становятся электрофильными , если у них есть правильные заместители .

Эта реакция отличается от обычной реакции S N 2 , поскольку она происходит на тригональном атоме углерода ( гибридизация sp 2 ). Механизм реакции S N 2 не происходит из-за стерических препятствий бензольного кольца. Чтобы атаковать атом C, нуклеофил должен приблизиться по линии связи C-LG (уходящая группа) сзади, где находится бензольное кольцо. Это следует общему правилу, по которому реакции S N 2 происходят только на тетраэдрическом атоме углерода.
Механизм S N 1 возможен, но очень неблагоприятен, если только уходящая группа не является исключительно хорошей. Он включал бы в себя неконтролируемую потерю уходящей группы и образование арильного катиона . В реакциях S N 1 все катионы, используемые в качестве промежуточных, были плоскими с пустой p-орбиталью . Этот катион плоский, но p-орбиталь заполнена (она является частью ароматического кольца), а пустая орбиталь является sp 2 -орбиталью вне кольца. [1]
Ароматические кольца подвергаются нуклеофильному замещению несколькими путями.



Механизм S N Ar является наиболее важным из них. Электроноакцепторные группы активируют кольцо к нуклеофильной атаке. Например, если есть нитрофункциональные группы, расположенные в орто- или пара- положении к галогенидной уходящей группе, механизм S N Ar является предпочтительным.
Ниже представлен механизм реакции нуклеофильного ароматического замещения 2,4-динитрохлорбензола ( 1 ) в щелочном растворе в воде.

Поскольку нитрогруппа является активатором нуклеофильного замещения и мета-директором, она способна стабилизировать дополнительную электронную плотность (через резонанс), когда ароматическое соединение подвергается атаке гидроксидного нуклеофила . Полученный промежуточный продукт, называемый комплексом Мейзенгеймера ( 2a ), ипсо- углерод временно связан с гидроксильной группой . Этот комплекс Мейзенгеймера дополнительно стабилизирован дополнительной электроноакцепторной нитрогруппой ( 2b ).
Чтобы вернуться в состояние с более низкой энергией, уходит либо гидроксильная группа, либо хлорид. В растворе происходят оба процесса. Небольшой процент промежуточного продукта теряет хлорид, чтобы стать продуктом (2,4-динитрофенол, 3 ), в то время как остальная часть возвращается в реагент ( 1 ). Поскольку 2,4-динитрофенол находится в состоянии с более низкой энергией, он не вернется, чтобы сформировать реагент, поэтому по прошествии некоторого времени реакция достигает химического равновесия , которое благоприятствует 2,4-динитрофенолу, который затем депротонируется основным раствором ( 4 ).
Образование резонансно-стабилизированного комплекса Мейзенгеймера происходит медленно, поскольку потеря ароматичности из-за нуклеофильной атаки приводит к более высокому энергетическому состоянию. По той же причине потеря хлорида или гидроксида происходит быстро, поскольку кольцо восстанавливает ароматичность. Недавние исследования показывают, что иногда комплекс Мейзенгеймера не всегда является истинным промежуточным продуктом, но может быть переходным состоянием процесса «фронтальной стороны S N 2», особенно если стабилизация электроноакцепторными группами не очень сильна. [2] В обзоре 2019 года утверждается, что такие «согласованные реакции S N Ar» более распространены, чем предполагалось ранее. [3]
Арилгалогениды не могут подвергаться классической реакции «обратной стороны» S N 2. Связь углерод-галоген находится в плоскости кольца, поскольку атом углерода имеет тригональную плоскую геометрию. Обратная атака блокируется, и поэтому эта реакция невозможна. [4] Реакция S N 1 возможна, но очень неблагоприятна. Она будет включать в себя неконтролируемую потерю уходящей группы и образование арильного катиона. [4] Нитрогруппа является наиболее часто встречающейся активирующей группой, другие группы - циано и ацильная группа. [5] Уходящая группа может быть галогеном или сульфидом. С увеличением электроотрицательности скорость реакции нуклеофильной атаки увеличивается. [5] Это связано с тем, что определяющим скорость этапом для реакции S N Ar является атака нуклеофила и последующее разрушение ароматической системы; более быстрый процесс - это благоприятное реформирование ароматической системы после потери уходящей группы. Таким образом, в отношении способности галогена отщеплять группу для S N Ar наблюдается следующая закономерность: F > Cl ≈ Br > I (т.е. обратный порядок по сравнению с ожидаемым для реакции S N 2). Если смотреть с точки зрения реакции S N 2, это может показаться противоречащим здравому смыслу, поскольку связь CF является одной из самых сильных в органической химии, тогда как фторид действительно является идеальной отщепляемой группой для S N Ar из-за чрезвычайной полярности связи CF. Нуклеофилами могут быть амины, алкоксиды , сульфиды и стабилизированные карбанионы . [5]
Ниже перечислены некоторые типичные реакции замещения аренов.
Однако нуклеофильное ароматическое замещение не ограничивается аренами; реакция протекает еще легче с гетероаренами . Пиридины особенно реакционноспособны при замещении в ароматическом орто-положении или ароматическом пара-положении, поскольку тогда отрицательный заряд эффективно делокализован в положении азота. Одной из классических реакций является реакция Чичибабина ( Алексей Чичибабин , 1914), в которой пиридин реагирует с амидом щелочного металла, таким как амид натрия, с образованием 2-аминопиридина. [6]
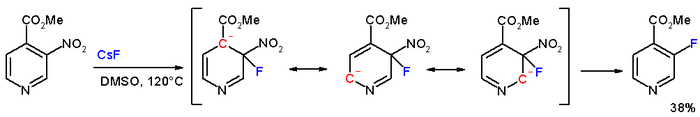
В соединении метил 3-нитропиридин-4-карбоксилат метанитрогруппа фактически замещена фтором с фторидом цезия в ДМСО при 120 °C. [7]
Хотя реакция Зандмейера солей диазония и галогенидов формально является нуклеофильным замещением, механизм реакции фактически радикальный . [8]
С углеродными нуклеофилами, такими как 1,3-дикарбонильные соединения, реакция была продемонстрирована как метод асимметричного синтеза хиральных молекул. [9] Впервые сообщено в 2005 году, органокатализатор (в двойной роли с ролью катализатора фазового переноса ) получен из цинхонидина ( бензилированного по N и O).