В органической химии ацилгалогенид (также известный как галогенангидрид ) представляет собой химическое соединение , полученное из оксокислоты [1] путем замены гидроксильной группы ( -OH ) галогенидной группой ( -X , где X представляет собой галоген ). [2]
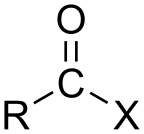
Если кислота представляет собой карбоновую кислоту ( -C(=O)OH ), соединение содержит функциональную группу -C(=O)X , которая состоит из карбонильной группы ( C=O ), одинарно связанной с атомом галогена. [3] Общая формула такого ацилгалогенида может быть записана как RCOX , где R может быть, например, алкильной группой, CO представляет собой карбонильную группу, а X представляет собой галогенид, такой как хлорид . Ацилхлориды являются наиболее часто встречающимися ацилгалогенидами, но ацетилйодид производится (временно) в крупнейших масштабах. Ежегодно при производстве уксусной кислоты образуются миллиарды килограммов . [4]
В промышленном масштабе реакция уксусного ангидрида с хлористым водородом дает смесь ацетилхлорида и уксусной кислоты: [5]
Обычные синтезы ацилхлоридов также включают реакцию карбоновых кислот с фосгеном , тионилхлоридом [6] и трихлоридом фосфора [7]. Пентабромид фосфора используется для получения ацилбромидов, которые редко представляют ценность.
Бензоилхлорид получают из бензотрихлорида с использованием воды или бензойной кислоты : [8]
Как и другие ацилхлориды , он может быть получен из исходной кислоты и других хлорирующих агентов, пентахлорида фосфора или тионилхлорида .
Репрезентативные лабораторные пути получения ароматических ацилгалогенидов сопоставимы с маршрутами для алифатических ацилгалогенидов. [9] Например, хлороформилирование, особый тип ацилирования Фриделя-Крафтса , при котором в качестве реагента используется формальдегид [ нужна ссылка ] , или путем прямого хлорирования производных бензальдегида . [10]
Коммерческий интерес представляет хлорангидриды ацилов , которые реагируют с HF с образованием ацилфторидов . [11] Ароматические (а также алифатические) ацилфториды удобно получать непосредственно из карбоновых кислот с использованием стабильных, недорогих химических веществ: PPh 3 , NBS и Et 3 N- 3 HF по настольному протоколу. [12] Цианурфторид превращает карбоновые кислоты в ацилфториды.
Карбоновые кислоты реагируют с тетрафторидом серы с образованием ацилфторида: [13]
Соответственно синтезируются ацилбромиды и йодиды, но они встречаются реже. [14]
Ацилгалогениды представляют собой довольно реакционноспособные соединения, которые часто синтезируют для использования в качестве промежуточных продуктов в синтезе других органических соединений. Например, ацилгалогенид может реагировать с:
В приведенных выше реакциях также образуется HX ( галогеноводород или галогеноводородная кислота). Например, если ацилгалогенид представляет собой ацилхлорид, также образуется HCl ( хлорид водорода или соляная кислота ).

Молекула может иметь более одной функциональной группы ацилгалогенида. Например, «адипоилдихлорид», обычно называемый просто адипоилхлоридом , имеет две функциональные группы ацилхлорида ; см. структуру справа. Это дихлорид (т.е. двойной хлорид) адипиновой кислоты 6-углеродной дикарбоновой кислоты . Важным применением адипоилхлорида является полимеризация с органическим диаминосоединением с образованием полиамида, называемого нейлоном , или полимеризация с некоторыми другими органическими соединениями с образованием полиэфиров .
Фосген (карбонилдихлорид, Cl–CO–Cl) – очень токсичный газ, представляющий собой дихлорид угольной кислоты (HO–CO–OH). Оба атома хлора в фосгене могут вступать в реакции, аналогичные предыдущим реакциям ацилгалогенидов. Фосген используется в качестве реагента в производстве поликарбонатных полимеров, а также в других отраслях промышленности.
Летучие ацилгалогениды вызывают слезоточивость , поскольку они могут вступать в реакцию с водой на поверхности глаза, образуя галогенводородные и органические кислоты, раздражающие глаза. Аналогичные проблемы могут возникнуть, если вдыхать пары ацилгалогенида. В целом ацилгалогениды (даже нелетучие соединения, такие как тозилхлорид ) вызывают раздражение глаз, кожи и слизистых оболочек .