Ферментативный катализ — это увеличение скорости процесса с помощью « фермента », биологической молекулы . Большинство ферментов — это белки, и большинство таких процессов — это химические реакции. Внутри фермента катализ обычно происходит в локализованном месте, называемом активным центром .
Большинство ферментов состоят преимущественно из белков, либо из одной белковой цепи, либо из множества таких цепей в многосубъединичном комплексе . Ферменты часто также включают небелковые компоненты, такие как ионы металлов или специализированные органические молекулы, известные как кофакторы (например, аденозинтрифосфат ). Многие кофакторы являются витаминами, и их роль как витаминов напрямую связана с их использованием в катализе биологических процессов в метаболизме. Катализ биохимических реакций в клетке жизненно важен, поскольку многие, но не все метаболически важные реакции имеют очень низкие скорости, когда не катализируются. Одним из двигателей эволюции белков является оптимизация таких каталитических активностей, хотя только самые важные ферменты работают вблизи пределов каталитической эффективности, и многие ферменты далеки от оптимальных. Важные факторы в катализе ферментов включают общий кислотный и основной катализ , орбитальное управление, энтропийное ограничение, эффекты ориентации (т. е. катализ типа «замок и ключ»), а также двигательные эффекты, связанные с динамикой белков [1]
Механизмы ферментативного катализа различаются, но все они в принципе схожи с другими типами химического катализа в том, что решающим фактором является снижение энергетического барьера(ов), разделяющего реагенты (или субстраты ) от продуктов. Снижение энергии активации ( E a ) увеличивает долю молекул реагентов, которые могут преодолеть этот барьер и образовать продукт. Важный принцип заключается в том, что поскольку они только снижают энергетические барьеры между продуктами и реагентами, ферменты всегда катализируют реакции в обоих направлениях и не могут продвигать реакцию вперед или влиять на положение равновесия — только на скорость, с которой оно достигается. Как и в случае с другими катализаторами, фермент не потребляется и не изменяется реакцией (как субстрат), а рециркулируется таким образом, что один фермент выполняет много раундов катализа.
Ферменты часто высокоспецифичны и действуют только на определенные субстраты. Некоторые ферменты абсолютно специфичны, то есть действуют только на один субстрат, в то время как другие проявляют групповую специфичность и могут действовать на похожие, но не идентичные химические группы, такие как пептидная связь в разных молекулах. Многие ферменты обладают стереохимической специфичностью и действуют на один стереоизомер , но не на другой. [2]

Классической моделью взаимодействия фермента и субстрата является модель индуцированного соответствия. [3] Эта модель предполагает, что первоначальное взаимодействие между ферментом и субстратом относительно слабое, но что эти слабые взаимодействия быстро вызывают конформационные изменения в ферменте, которые усиливают связывание.
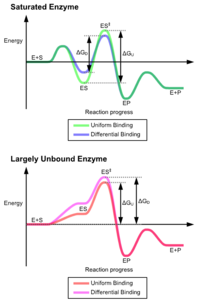
Преимущества механизма индуцированного соответствия возникают из-за стабилизирующего эффекта сильного связывания фермента. Существует два различных механизма связывания субстрата: равномерное связывание, которое имеет сильное связывание субстрата, и дифференциальное связывание, которое имеет сильное связывание переходного состояния. Стабилизирующий эффект равномерного связывания увеличивает как связывание субстрата, так и связывание переходного состояния, в то время как дифференциальное связывание увеличивает только связывание переходного состояния. Оба используются ферментами и были эволюционно выбраны для минимизации энергии активации реакции. Ферменты, которые являются насыщенными, то есть имеют высокое сродство связывания субстрата, требуют дифференциального связывания для снижения энергии активации, тогда как небольшие несвязанные с субстратом ферменты могут использовать либо дифференциальное, либо однородное связывание. [4]
Эти эффекты привели к тому, что большинство белков используют механизм дифференциального связывания для снижения энергии активации, поэтому большинство субстратов имеют высокое сродство к ферменту в переходном состоянии. Дифференциальное связывание осуществляется с помощью механизма индуцированного соответствия — субстрат сначала связывается слабо, затем фермент изменяет конформацию, увеличивая сродство к переходному состоянию и стабилизируя его, тем самым снижая энергию активации для его достижения.
Однако важно прояснить, что концепция индуцированного соответствия не может быть использована для обоснования катализа. То есть химический катализ определяется как уменьшение E a ‡ (когда система уже находится в ES ‡ ) относительно E a ‡ в некатализированной реакции в воде (без фермента). Индуцированное соответствие только предполагает, что барьер ниже в закрытой форме фермента, но не говорит нам, в чем причина уменьшения барьера.
Индуцированное соответствие может быть полезным для точности молекулярного распознавания в присутствии конкуренции и шума посредством механизма конформационной проверки . [5]
Эти конформационные изменения также приближают каталитические остатки в активном центре к химическим связям в субстрате, которые будут изменены в реакции. После связывания один или несколько механизмов катализа снижают энергию переходного состояния реакции , предоставляя альтернативный химический путь для реакции. Существует шесть возможных механизмов катализа «через барьер», а также механизм «через барьер»:
Взаимодействие фермента с субстратом выравнивает химические группы и удерживает их близко друг к другу в оптимальной геометрии, что увеличивает скорость реакции. Это снижает энтропию реагентов и, таким образом, делает реакции присоединения или переноса менее неблагоприятными, поскольку снижение общей энтропии происходит, когда два реагента становятся одним продуктом. Однако это общий эффект, и он наблюдается в реакциях без присоединения или переноса, где он происходит из-за увеличения «эффективной концентрации» реагентов. Это становится понятно при рассмотрении того, как увеличение концентрации приводит к увеличению скорости реакции: по сути, когда реагенты более концентрированы, они сталкиваются чаще и, следовательно, реагируют чаще. В ферментативном катализе связывание реагентов с ферментом ограничивает конформационное пространство реагентов, удерживая их в «правильной ориентации» и близко друг к другу, так что они сталкиваются чаще и с правильной геометрией, чтобы облегчить желаемую реакцию. «Эффективная концентрация» — это концентрация, которую должен иметь реагент, свободный в растворе, чтобы испытывать ту же частоту столкновений. Часто такие теоретически эффективные концентрации нефизичны и нереализуемы в реальности, что свидетельствует о большой каталитической силе многих ферментов, скорость которых значительно возрастает по сравнению с некатализированным состоянием.
Однако ситуация может быть более сложной, поскольку современные вычислительные исследования установили, что традиционные примеры эффектов близости не могут быть напрямую связаны с энтропийными эффектами ферментов. [6] [7] [8] Кроме того, было обнаружено, что первоначальное энтропийное предложение [9] в значительной степени переоценивает вклад энтропии ориентации в катализ. [10]
Доноры и акцепторы протонов, т. е. кислоты и основания , могут отдавать и принимать протоны для стабилизации развивающихся зарядов в переходном состоянии. Это связано с общим принципом катализа, принципом снижения энергетических барьеров, поскольку в целом переходные состояния являются состояниями с высокой энергией, и при их стабилизации эта высокая энергия снижается, снижая барьер. Ключевой особенностью ферментативного катализа по сравнению со многими небиологическими катализами является то, что и кислотный, и основной катализ могут быть объединены в одной и той же реакции. Во многих абиотических системах кислоты (большие [H+]) или основания (большие концентрации H+-приемников или виды с электронными парами) могут увеличивать скорость реакции; но, конечно, среда может иметь только один общий pH (мера кислотности или основности (щелочности)). Однако, поскольку ферменты являются большими молекулами, они могут располагать как кислотные, так и основные группы в своем активном центре для взаимодействия со своими субстратами и использовать оба режима независимо от общего pH.
Часто общий кислотный или основной катализ используется для активации нуклеофильных и/или электрофильных групп или для стабилизации уходящих групп. Многие аминокислоты с кислотными или основными группами используются в активном центре, такие как глутаминовая и аспарагиновая кислота, гистидин, цистин, тирозин, лизин и аргинин, а также серин и треонин. Кроме того, часто используется пептидный остов с карбонильными и амидными N-группами. Цистин и гистидин очень часто участвуют, так как они оба имеют pKa, близкий к нейтральному pH , и поэтому могут как принимать, так и отдавать протоны.
Многие механизмы реакции, включающие кислотно-основной катализ, предполагают существенно измененную pKa. Это изменение pKa возможно через локальное окружение остатка [ требуется цитата ] .
На pKa также может существенно влиять окружающая среда, в той степени, в которой остатки, имеющие основные свойства в растворе, могут выступать в качестве доноров протонов, и наоборот.
Модификация pKa является чистой частью электростатического механизма. [11] Каталитический эффект приведенного выше примера в основном связан с уменьшением pKa оксианиона и увеличением pKa гистидина, в то время как перенос протона от серина к гистидину не катализируется в значительной степени, поскольку он не является барьером, определяющим скорость. [12] Обратите внимание, что в показанном примере сопряженная кислота гистидина действует как общий кислотный катализатор для последующей потери амина из тетраэдрического промежуточного соединения. Однако доказательства, подтверждающие этот предложенный механизм (рисунок 4 в ссылке 13) [13] , были оспорены. [14]
Стабилизация заряженных переходных состояний может также осуществляться остатками в активном центре, образующими ионные связи (или частичные взаимодействия ионных зарядов) с промежуточным соединением. Эти связи могут возникать либо из кислотных , либо из основных боковых цепей, обнаруженных в аминокислотах, таких как лизин , аргинин , аспарагиновая кислота или глутаминовая кислота , либо из металлических кофакторов , таких как цинк . Ионы металлов особенно эффективны и могут снизить pKa воды достаточно, чтобы сделать ее эффективным нуклеофилом.
Систематические исследования компьютерного моделирования установили, что электростатические эффекты дают, безусловно, наибольший вклад в катализ. [11] Он может увеличить скорость реакции в 10 7 раз . [15] В частности, было обнаружено, что фермент обеспечивает среду, которая более полярна, чем вода, и что ионные переходные состояния стабилизируются фиксированными диполями. Это сильно отличается от стабилизации переходного состояния в воде, где молекулы воды должны платить «энергией реорганизации». [16] Для того, чтобы стабилизировать ионные и заряженные состояния. Таким образом, катализ связан с тем, что полярные группы фермента предорганизованы [17]
Было показано, что величина электростатического поля, создаваемого активным центром фермента, тесно связана с повышением каталитической скорости фермента. [18]
Связывание субстрата обычно исключает воду из активного центра, тем самым понижая локальную диэлектрическую проницаемость до уровня органического растворителя. Это усиливает электростатические взаимодействия между заряженными/полярными субстратами и активными центрами. Кроме того, исследования показали, что распределение заряда вокруг активных центров организовано таким образом, чтобы стабилизировать переходные состояния катализируемых реакций. В нескольких ферментах это распределение заряда, по-видимому, служит для направления полярных субстратов к их центрам связывания, так что скорости этих ферментативных реакций превышают их кажущиеся пределы, контролируемые диффузией [ необходима ссылка ] .
Ковалентный катализ включает в себя образование субстратом временной ковалентной связи с остатками в активном центре фермента или с кофактором. Это добавляет дополнительный ковалентный промежуточный продукт к реакции и помогает снизить энергию более поздних переходных состояний реакции. Ковалентная связь должна быть разорвана на более поздней стадии реакции для регенерации фермента. Этот механизм используется каталитической триадой ферментов, таких как протеазы, такие как химотрипсин и трипсин , где образуется промежуточный ацил-фермент. Альтернативным механизмом является образование основания Шиффа с использованием свободного амина из остатка лизина , как это наблюдается в ферменте альдолазе во время гликолиза .
Некоторые ферменты используют неаминокислотные кофакторы , такие как пиридоксальфосфат (PLP) или тиаминпирофосфат (TPP), для образования ковалентных промежуточных соединений с молекулами реагентов. [19] [20] Такие ковалентные промежуточные соединения функционируют для снижения энергии более поздних переходных состояний, подобно тому, как ковалентные промежуточные соединения, образованные с остатками аминокислот активного центра, позволяют стабилизировать, но возможности кофакторов позволяют ферментам проводить реакции, которые не могли бы выполнять только остатки аминокислот. Ферменты, использующие такие кофакторы, включают PLP-зависимый фермент аспартаттрансаминазу и TPP-зависимый фермент пируватдегидрогеназу . [21] [22]
Вместо того, чтобы понижать энергию активации для пути реакции, ковалентный катализ обеспечивает альтернативный путь для реакции (через ковалентный промежуточный продукт) и поэтому отличается от истинного катализа. [11] Например, энергетику ковалентной связи с молекулой серина в химотрипсине следует сравнивать с хорошо изученной ковалентной связью с нуклеофилом в некатализированной реакции в растворе. Истинное предложение ковалентного катализа (где барьер ниже, чем соответствующий барьер в растворе) потребовало бы, например, частичной ковалентной связи с переходным состоянием ферментной группой (например, очень сильной водородной связи), и такие эффекты не вносят существенного вклада в катализ.
Ион металла в активном центре участвует в катализе, координируя стабилизацию заряда и экранирование. Из-за положительного заряда металла только отрицательные заряды могут быть стабилизированы посредством ионов металла. [23] Однако ионы металла имеют преимущества в биологическом катализе, поскольку на них не влияют изменения pH. [24] Ионы металла также могут ионизировать воду, действуя как кислота Льюиса . [25] Ионы металла также могут быть агентами окисления и восстановления. [26]
Это основной эффект индуцированного связывания, когда сродство фермента к переходному состоянию больше, чем к самому субстрату. Это вызывает структурные перестройки, которые напрягают связи субстрата в положение, более близкое к конформации переходного состояния, тем самым снижая разницу энергий между субстратом и переходным состоянием и помогая катализировать реакцию.
Однако эффект деформации на самом деле является эффектом дестабилизации основного состояния, а не эффектом стабилизации переходного состояния. [11] [27] [ нужна страница ] Кроме того, ферменты очень гибки и не могут применять большой эффект деформации. [28]
Помимо деформации связей в субстрате, деформация связей может также возникать внутри самого фермента для активации остатков в активном центре.
Эти традиционные механизмы «через барьер» в некоторых случаях были оспорены моделями и наблюдениями механизмов «через барьер» ( квантовое туннелирование ). Некоторые ферменты работают с кинетикой, которая быстрее, чем та, которая была бы предсказана классическим ΔG ‡ . В моделях «через барьер» протон или электрон могут туннелировать через активационные барьеры. [30] [31] Квантовое туннелирование для протонов наблюдалось при окислении триптамина ароматической аминдегидрогеназой . [32]
Квантовое туннелирование, по-видимому, не обеспечивает существенного каталитического преимущества, поскольку туннельные вклады схожи в катализируемых и некатализируемых реакциях в растворе. [31] [33] [34] [35] Однако туннельный вклад (обычно увеличивающий константы скорости примерно в 1000 раз [32] по сравнению со скоростью реакции для классического «через барьер» пути) вероятно имеет решающее значение для жизнеспособности биологических организмов. Это подчеркивает общую важность туннельных реакций в биологии.
В 1971-1972 годах была сформулирована первая квантово-механическая модель ферментативного катализа. [36] [37] [ необходим сторонний источник ]
Энергия связи комплекса фермент-субстрат не может рассматриваться как внешняя энергия, необходимая для активации субстрата. Фермент с высоким содержанием энергии может сначала перенести некоторую специфическую энергетическую группу X 1 из каталитического центра фермента в конечное место первого связанного реагента, затем другая группа X 2 из второго связанного реагента (или из второй группы одного реагента) должна быть перенесена в активный центр для завершения превращения субстрата в продукт и регенерации фермента. [38]
Мы можем представить всю ферментативную реакцию как две реакции сочетания:
Из реакции ( 1 ) можно видеть , что группа X 1 активного фермента появляется в продукте из-за возможности реакции обмена внутри фермента, чтобы избежать как электростатического ингибирования, так и отталкивания атомов. Таким образом, мы представляем активный фермент как мощный реагент ферментативной реакции. Реакция ( 2 ) показывает неполное превращение субстрата, поскольку его группа X 2 остается внутри фермента. Этот подход как идея ранее предлагался, полагаясь на гипотетические чрезвычайно высокие ферментативные превращения (каталитически совершенный фермент). [39]
Решающим моментом для проверки настоящего подхода является то, что катализатор должен быть комплексом фермента с группой переноса реакции. Этот химический аспект поддерживается хорошо изученными механизмами нескольких ферментативных реакций. Рассмотрим реакцию гидролиза пептидной связи, катализируемую чистым белком α-химотрипсином (фермент, действующий без кофактора), который является хорошо изученным членом семейства сериновых протеаз, см. [40]
Мы представляем экспериментальные результаты этой реакции в виде двух химических стадий:
где S 1 — полипептид, P 1 и P 2 — продукты. Первый химический шаг ( 3 ) включает образование ковалентного ацил-ферментного промежуточного соединения. Второй шаг ( 4 ) — шаг деацилирования. Важно отметить, что группа H+, изначально находящаяся на ферменте, но не в воде, появляется в продукте до шага гидролиза, поэтому ее можно рассматривать как дополнительную группу ферментативной реакции.
Таким образом, реакция ( 3 ) показывает, что фермент действует как мощный реагент реакции. Согласно предложенной концепции, транспорт H от фермента способствует первому превращению реагента, разрыву первой исходной химической связи (между группами P1 и P2 ) . Стадия гидролиза приводит к разрыву второй химической связи и регенерации фермента.
Предложенный химический механизм не зависит от концентрации субстратов или продуктов в среде. Однако сдвиг их концентрации в основном вызывает изменения свободной энергии на первом и последнем этапах реакций ( 1 ) и ( 2 ) из-за изменений в содержании свободной энергии каждой молекулы, будь то S или P, в водном растворе. Этот подход соответствует следующему механизму мышечного сокращения. Конечным этапом гидролиза АТФ в скелетных мышцах является высвобождение продукта, вызванное ассоциацией головок миозина с актином. [41] Закрытие щели связывания актина во время реакции ассоциации структурно сопряжено с открытием кармана связывания нуклеотида на активном сайте миозина. [42]
Примечательно, что конечные этапы гидролиза АТФ включают быстрое высвобождение фосфата и медленное высвобождение АДФ. [43] [44] Высвобождение фосфатного аниона из связанного аниона АДФ в водный раствор можно рассматривать как экзергоническую реакцию, поскольку фосфатный анион имеет низкую молекулярную массу.
Таким образом, мы приходим к выводу, что первичное высвобождение неорганического фосфата H 2 PO 4 − приводит к трансформации значительной части свободной энергии гидролиза АТФ в кинетическую энергию сольватированного фосфата, производя активное течение. Это предположение о локальной механохимической трансдукции согласуется с механизмом мышечного сокращения Тироша, где мышечная сила возникает из интегрированного действия активного течения, созданного гидролизом АТФ. [45] [46]
В действительности большинство ферментативных механизмов включают комбинацию нескольких различных типов катализа.
Триозофосфатизомераза ( КФ 5.3.1.1) катализирует обратимое взаимопревращение двух изомеров триозофосфата — дигидроксиацетонфосфата и D- глицеральдегид-3-фосфата .
Трипсин ( EC 3.4.21.4) — это сериновая протеаза , которая расщепляет белковые субстраты после остатков лизина или аргинина , используя каталитическую триаду для осуществления ковалентного катализа и оксианионную дырку для стабилизации накопления заряда в переходных состояниях .
Альдолаза ( EC 4.1.2.13) катализирует расщепление фруктозо-1,6-бисфосфата (F-1,6-BP) на глицеральдегид-3-фосфат и дигидроксиацетонфосфат ( DHAP ).
Появление исследований отдельных молекул в 2010-х годах привело к наблюдению, что движение несвязанных ферментов увеличивается с увеличением концентрации субстрата и увеличением энтальпии реакции . [47] Последующие наблюдения показывают, что это увеличение диффузионной способности обусловлено временным смещением центра масс фермента , что приводит к «эффекту отдачи, который толкает фермент». [48]
Сходство между ферментативными реакциями (EC) можно рассчитать, используя изменения связей, реакционные центры или показатели субструктуры (EC-BLAST, архивировано 30 мая 2019 г. на Wayback Machine ). [49]