

Вирусная нейраминидаза — это тип нейраминидазы, обнаруженный на поверхности вирусов гриппа , который позволяет вирусу высвобождаться из клетки-хозяина. Нейраминидазы — это ферменты , которые отщепляют группы сиаловой кислоты (также называемые нейраминовой кислотой ) от гликопротеинов . Вирусная нейраминидаза была открыта Альфредом Готтшалком в Институте Уолтера и Элизы Холл в 1957 году. [3] Ингибиторы нейраминидазы — это противовирусные агенты, которые подавляют активность нейраминидазы вируса гриппа и имеют большое значение в борьбе с гриппом. [4]
Вирусные нейраминидазы являются членами семейства гликозидгидролаз 34 CAZY GH_34, которое включает ферменты с единственной известной активностью: сиалидаза или нейраминидаза EC 3.2.1.18. Нейраминидазы отщепляют терминальные остатки сиаловой кислоты от углеводных цепей в гликопротеинах. Сиаловая кислота — это отрицательно заряженный сахар, связанный с белковыми и липидными частями липопротеинов . [ требуется ссылка ]
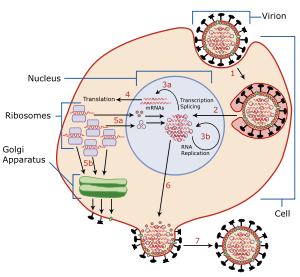
Чтобы заразить клетку-хозяина, вирус гриппа прикрепляется к внешней поверхности клетки с помощью гемагглютинина , молекулы, обнаруженной на поверхности вируса, которая связывается с группами сиаловой кислоты. Сиаловые кислоты находятся на различных гликопротеинах на поверхности клетки-хозяина. Затем вирус перемещается от группы сиаловой кислоты к группе сиаловой кислоты, пока не найдет нужный рецептор на поверхности клетки (чья идентичность остается неизвестной). [5] Нейраминадаза обеспечивает это перемещение, расщепляя группы сиаловой кислоты, к которым был прикреплен гемагглютинин. После того, как вирус проник в клетку и реплицировался, новые вирусные частицы отпочковываются от мембраны клетки-хозяина. Гемагглютинин на новых вирусных частицах остается прикрепленным к группам сиаловой кислоты гликопротеинов на внешней поверхности клетки и поверхности других вирусных частиц; нейраминадаза расщепляет эти группы и тем самым позволяет вирусным частицам высвобождаться [6] и предотвращает самоагрегацию. [5] Нейраминадаза также облегчает перемещение вирусных частиц в присутствии слизи, богатой кремниевой кислотой. [5]
Один белок гемагглютинин-нейраминидаза может сочетать функции нейраминидазы и гемагглютинина , например, в вирусе эпидемического паротита и вирусе парагриппа человека . [ необходима цитата ]
Фермент помогает вирусам высвобождаться после отпочкования от плазматической мембраны клетки-хозяина. Мембраны вируса гриппа содержат два гликопротеина : гемагглютинин и нейраминидазу. Хотя гемагглютинин на поверхности вириона необходим для заражения, его присутствие подавляет высвобождение частицы после отпочкования. Вирусная нейраминидаза расщепляет терминальные остатки сиаловой кислоты от гликановых структур на поверхности инфицированной клетки. Это способствует высвобождению потомства вирусов и распространению вируса из клетки-хозяина в незараженные окружающие клетки. Нейраминидаза также расщепляет остатки сиаловой кислоты от вирусных белков, предотвращая агрегацию вирусов. [ необходима медицинская цитата ]
Нейраминидаза была целью структурно-ориентированных программ разработки ингибиторов ферментов, которые привели к производству двух препаратов: занамивира (Relenza) и осельтамивира (Tamiflu). Введение ингибиторов нейраминидазы является лечением, которое ограничивает тяжесть и распространение вирусных инфекций. Ингибиторы нейраминидазы полезны для борьбы с инфекцией гриппа : занамивир , вводимый путем ингаляции; осельтамивир , вводимый перорально; и в настоящее время исследуется перамивир, вводимый парентерально, то есть посредством внутривенной или внутримышечной инъекции. [ необходима цитата ]
27 февраля 2005 года было зафиксировано, что 14-летняя вьетнамская девочка является носителем штамма вируса гриппа H5N1 , устойчивого к препарату осельтамивир . Препарат используется для лечения пациентов, заразившихся гриппом. Однако вьетнамская девочка, которая получила профилактическую дозу (75 мг один раз в день), оказалась невосприимчивой к лекарству. В связи с растущими опасениями глобальной пандемии птичьего гриппа ученые начали искать причину устойчивости к лекарству Тамифлю . Было установлено, что причиной является замена гистидина на тирозин ( аминокислота ) в позиции 274 в белке нейраминидазы. [ необходима цитата ]
Поскольку штаммы гриппа постоянно мутируют, крайне важно, чтобы ученые быстро и эффективно определили правильный подтип нейраминидазы, который отвечает за устойчивость к препаратам , чтобы разработать лекарства, которые будут бороться с определенными штаммами гриппа. [ необходима цитата ]
Новый класс ингибиторов нейраминидазы, которые ковалентно присоединяются к ферменту, проявил активность против лекарственно-устойчивого вируса in vitro . [7] [8]
В идеальных обстоятельствах нейраминидаза вируса гриппа (NA) должна воздействовать на тот же тип рецептора, с которым связывается вирусный гемагглютинин (HA), явление, которое происходит не всегда. Не совсем ясно, как вирусу удается функционировать, когда нет близкого соответствия между специфичностями NA и HA. [ необходима цитата ]
Ферменты нейраминидазы могут иметь эндо- или экзогликозидазную активность и классифицируются как EC 3.2.1.29 (эндонейраминидаза) [9] и EC 3.2.1.18 (экзонейраминидазы). [10] В целом остатки сиаловой кислоты млекопитающих находятся в терминальных положениях (нередуцирующий конец) в сложных гликанах, и поэтому вирусные нейраминидазы, которые являются экзогликозидазными ферментами , используют эти терминальные остатки в качестве своих субстратов. [ необходима цитата ]