Вицинальная дифункционализация относится к химической реакции , включающей преобразования в двух соседних центрах (чаще всего углеродах). Это преобразование может быть осуществлено в α,β-ненасыщенных карбонильных соединениях посредством сопряженного присоединения нуклеофила к β-положению с последующим захватом полученного енолята электрофилом в α-положении. Когда нуклеофил является енолятом , а электрофил — протоном , реакция называется присоединением Михаэля . [1 ]
Реакции вицинальной дифункционализации, как правило, приводят к образованию новых связей на двух соседних атомах углерода. Часто это происходит стереоконтролируемым образом, особенно если обе связи образуются одновременно, как в реакции Дильса-Альдера . Активированные двойные связи представляют собой полезный рычаг для вицинальной дифункционализации, поскольку они могут действовать как нуклеофилы и электрофилы — один углерод обязательно беден электронами, а другой богат электронами. В присутствии нуклеофила и электрофила, тогда, два углерода двойной связи могут действовать как «реле», опосредуя поток электронов от нуклеофила к электрофилу с образованием двух , а не одной обычной, химических связей.
(1)
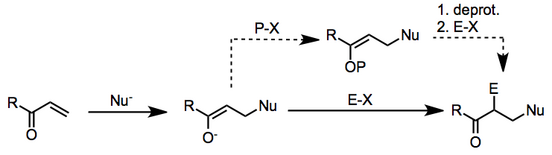
Чаще всего в качестве нуклеофила в данном контексте используют металлоорганическое соединение, а в качестве электрофила — алкилгалогенид .
Механизм протекает в две стадии: β-нуклеофильное присоединение к ненасыщенному карбонилу с последующим электрофильным замещением у α-углерода образующегося енолята .
Когда нуклеофилом является металлоорганический реагент, механизмы первой стадии могут различаться. В некоторых случаях неясно, происходят ли реакции по ионным или радикальным механизмам. [2] Исследования показали, что вторая стадия может даже протекать посредством одноэлектронных переносов, когда восстановительный потенциал электрофила низок. [3] Общая схема, включающая ионные промежуточные продукты, показана ниже.
(2)
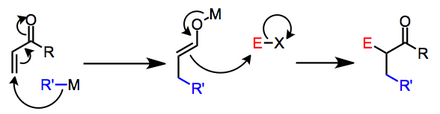
Органокупраты лития подвергаются окислительному присоединению к енонам, давая после восстановительного элиминирования видов органомедни(III) β-замещенные еноляты лития. [4]
В любом случае, второй шаг хорошо описывается во всех случаях как реакция енолята с электрофилом. Два шага могут быть выполнены как отдельные экспериментальные операции, если первоначально образованный енолят защищен после β-присоединения. Однако, если два шага не являются отдельными, противоион енолята определяется противоионом нуклеофильного исходного материала и может существенно влиять на реакционную способность енолята.
Контроль стерического подхода является обычным в реакциях сопряженного присоединения. Таким образом, в циклических субстратах транс- отношение между заместителями на α- и β-углеродах является обычным. Конфигурация в α-положении менее предсказуема, особенно в случаях, когда может происходить эпимеризация. На основе контроля стерического подхода предсказывается, что новый α-заместитель будет транс-положением к новому β-заместителю, и это наблюдается в ряде случаев. [5]
(3)
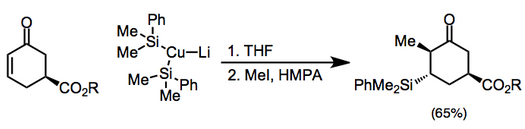
Медноорганические реагенты являются наиболее распространенными нуклеофилами для стадии β-присоединения. Эти реагенты могут быть получены каталитически в присутствии реактивов Гриньяра с использованием солей меди(I) или меди(II). [6]
(4)
Медные реагенты также могут использоваться стехиометрически, и среди них наиболее распространены органокупраты (они более реакционноспособны, чем соответствующие нейтральные органомедные(I) соединения). Противоион купрата может влиять на реакцию присоединения и последующую енолятную реакцию тонкими способами. [7] Присоединения, включающие купраты более высокого порядка, должны быть погашены силилгалогенидом перед алкилированием. [8](5)
При использовании несимметричных купратов группа, связь углерода с медью которой содержит меньше s-характера, почти всегда переносится в β-положение. Однако существуют некоторые исключения. [9] В приведенном ниже примере проведение реакции в ТГФ привело к переносу винильного фрагмента, тогда как другие растворители способствовали переносу метильной группы.
(6)
Еноляты также могут использоваться в качестве нуклеофилов для вицинальных реакций дифункционализации. Чтобы предотвратить простое присоединение Михаэля (которое завершается протонированием промежуточного енолята), захват электрофилом должен быть внутримолекулярным. [10]
(7)
При рассмотрении электрофила следует учитывать природу конъюгата енолята, полученного после первого шага. Следует использовать относительно реактивные алкилирующие агенты, особенно в случаях, связанных с добавлением купратов (еноляты, полученные в результате добавления купратов, часто нереакционноспособны). Оксофильных электрофилов следует избегать, если желательно С-алкилирование. Электрофилы также должны не иметь водородов, достаточно кислых, чтобы депротонироваться енолятом.
Циклические α,β-ненасыщенные кетоны являются наиболее часто используемыми субстратами для вицинальной дифункционализации. Они, как правило, более реакционноспособны, чем ациклические аналоги, и подвергаются меньшему прямому присоединению, чем альдегиды. Амиды и эфиры могут использоваться для поощрения сопряженного присоединения в случаях, когда прямое присоединение может быть конкурентным (как при добавлении литийорганических соединений). [11]
(8)
Поскольку этап присоединения очень чувствителен к стерическим эффектам, β-заместители, вероятно, замедляют реакцию. Ацетиленовые и алленовые субстраты реагируют, давая продукты с некоторой сохраненной ненасыщенностью. [12] [13]
(9)
В литературе имеется большое количество примеров вицинальной дифункционализации ненасыщенных карбонильных соединений. В одном примере дифункционализация ненасыщенного лактона 1 была использована на пути к изостегану. Это преобразование было выполнено в одном сосуде. [14]
(10)
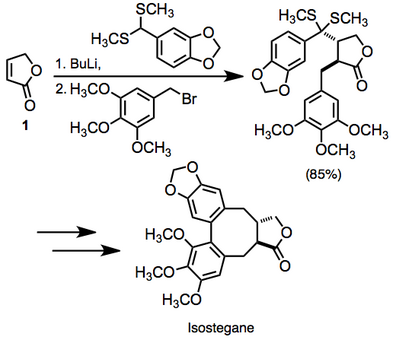
Поскольку реакция создает две новые связи с умеренно высокой степенью стереоконтроля, она представляет собой высококонвергентный синтетический метод.
Металлоорганические нуклеофилы, используемые для сопряженных присоединений, чаще всего готовятся in situ . Необходимо использование безводного оборудования и инертной атмосферы. Поскольку эти факторы иногда трудно контролировать, а сила свежеприготовленных реагентов может существенно различаться, для проверки чистоты реагентов необходимы методы титрования . Существует ряд эффективных методик титрования. [15]
Обычно вицинальные дифункционализации проводятся в одном сосуде, без посредничества нейтрального защищенного енолята. Однако в определенных случаях может потребоваться защитить промежуточное соединение β-присоединения. Однако до достижения этой точки можно провести экранирование растворителя и нуклеофила, корректировку порядка добавления и корректировку противоиона для оптимизации однореакторного процесса для определенной комбинации карбонильного соединения, нуклеофила и алкилирующего (или ацилирующего) агента. Корректировка растворителя между двумя этапами является обычным явлением; если используется один растворитель, предпочтительным растворителем является тетрагидрофуран . Полярных апротонных растворителей следует избегать для этапа присоединения конъюгата. Что касается температуры, присоединения конъюгатов обычно проводятся при низких температурах (-78 °C), в то время как алкилирования проводятся при несколько более высоких температурах (от 0 до -30 °C). Менее реакционноспособные алкилирующие агенты могут потребовать комнатной температуры.
(11)
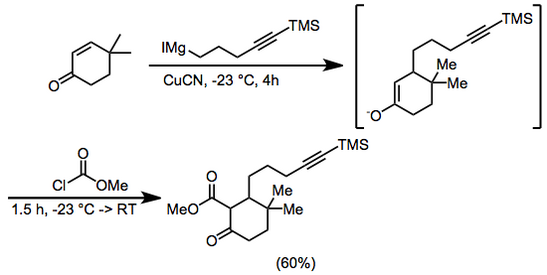
К 6,25 г (50 ммоль) 4,4-диметил-2-циклогексен-1-она и 0,5 г (5,6 ммоль) цианида меди в 400 мл диэтилового эфира при –23° под аргоном добавляли 100 мл (~0,75 М в диэтиловом эфире) 5-триметилсилил-4-пентинилмагнийиодида в течение 4 часов. Добавляли метилхлорформиат (8 мл, 100 ммоль) и продолжали перемешивание в течение 1 часа при –23° и 0,5 часа при комнатной температуре. Затем добавляли соляную кислоту (100 мл, 2,0 М), органическую фазу отделяли и сушили сульфатом магния . Растворитель удаляли, а остаток хроматографировали на силикагеле с использованием 5% диэтилового эфира – петролейного эфира, получая метил 3,3-диметил-6-оксо-2-[5-(триметилсилил)-4-пентинил]циклогексанкарбоксилат, 9,66 г (60%). ИК 2000, 2140, 1755, 1715, 1660, 1615, 1440, 1280, 1250, 1225, 1205 и 845 см–1; 1H ЯМР (CDCl3 ) δ 0,13 (с, 9H), 0,93 (с, 3H), 1,02 (с, 3H), 1,2–2,3 (м, 11H), 3,74 (с, 3H). Аналитический расчет. для C18H30O3Si : C, 67,05; H, 9,4. Найдено: C, 67,1; H , 9,65 .