Восстановительное элиминирование — элементарный этап металлоорганической химии , при котором степень окисления металлического центра снижается при образовании новой ковалентной связи между двумя лигандами . Это микроскопическая противоположность окислительного присоединения , которая часто является стадией образования продукта во многих каталитических процессах. Поскольку окислительное присоединение и восстановительное отщепление являются обратными реакциями, для обоих процессов действуют одни и те же механизмы, а равновесие продуктов зависит от термодинамики обоих направлений. [1] [2]
Восстановительное элиминирование часто наблюдается при более высоких степенях окисления и может включать двухэлектронное изменение в одном металлическом центре (моноядерное) или одноэлектронное изменение в каждом из двух металлических центров (биядерное, биядерное или биметаллическое). [1] [2]
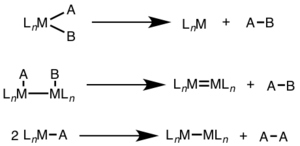
При моноядерном восстановительном элиминировании степень окисления металла снижается на два, а количество d-электронов в металле увеличивается на два. Этот путь является общим для металлов d 8 Ni(II), Pd(II), Au(III) и металлов d 6 Pt(IV), Pd(IV), Ir(III) и Rh(III). Кроме того, моноядерное восстановительное элиминирование требует, чтобы удаляемые группы были цис-по отношению друг к другу по металлическому центру. [3]

При биядерном восстановительном элиминировании степень окисления каждого металла уменьшается на единицу, а количество d-электронов каждого металла увеличивается на единицу. Этот тип реакционной способности обычно наблюдается с металлами первого ряда, которые предпочитают изменение степени окисления на одну единицу, но наблюдался как у металлов второго, так и третьего ряда. [4]
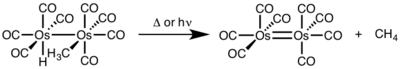
Как и при окислительном присоединении, при восстановительном элиминировании возможно несколько механизмов. Основным механизмом является согласованный путь, что означает, что это неполярное трехцентровое переходное состояние с сохранением стереохимии . Кроме того, другими возможными путями восстановительного элиминирования являются механизм S N 2 , который протекает с инверсией стереохимии, или радикальный механизм, который протекает с уничтожением стереохимии. [1]
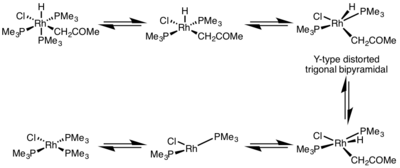
На скорость восстановительного элиминирования большое влияние оказывает геометрия металлокомплекса. В октаэдрических комплексах восстановительное элиминирование может быть очень медленным из координационно-насыщенного центра, и часто восстановительное элиминирование происходит только по диссоциативному механизму, когда лиганд должен первоначально диссоциировать, чтобы образовать пятикоординационный комплекс. Этот комплекс принимает искаженную тригонально-бипирамидальную структуру Y-типа, где π-донорный лиганд находится в базальном положении, а две группы, подлежащие удалению, сближаются очень близко друг к другу. После элиминирования образуется Т-образный трехкоординатный комплекс, который связывается с лигандом, образуя плоский квадратный четырехкоординатный комплекс. [5]
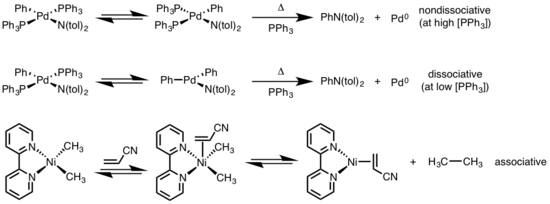
Редукционная элиминация плоско-квадратных комплексов может развиваться посредством различных механизмов: диссоциативного , недиссоциативного и ассоциативного . Подобно октаэдрическим комплексам, диссоциативный механизм для плоских квадратных комплексов начинается с потери лиганда, в результате чего образуется трехкоординатный промежуточный продукт, который подвергается восстановительному элиминированию с образованием однокоординационного металлокомплекса. В случае недиссоциативного пути редукционное элиминирование происходит из четырехкоординатной системы с образованием двухкоординатного комплекса. Если элиминирующие лиганды являются транс-по отношению друг к другу, перед элиминацией комплекс должен сначала подвергнуться транс-изомеризации в цис-изомеризацию . В ассоциативном механизме лиганд должен первоначально ассоциироваться с четырехкоординационным комплексом металла, чтобы образовать пятикоординационный комплекс, который подвергается восстановительному элиминированию, синониму механизма диссоциации для октаэдрических комплексов. [6] [7]
Восстановительное элиминирование чувствительно к множеству факторов, включая: 1) идентичность металла и электронную плотность; 2) стерики; 3) участвующие лиганды; 4) координационный номер ; 5) геометрия ; и 6) фотолиз /окисление. Кроме того, поскольку восстановительное отщепление и окислительное присоединение являются обратными реакциями, любые стерические элементы или электроника, повышающие скорость восстановительного отщепления, должны термодинамически препятствовать скорости окислительного присоединения. [2]
Металлокомплексы первого ряда имеют тенденцию подвергаться восстановительному элиминированию быстрее, чем металлокомплексы второго ряда, которые, как правило, проходят быстрее, чем металлокомплексы третьего ряда. Это связано с прочностью связи: связи металл-лиганд в комплексах первого ряда слабее, чем связи металл-лиганд в комплексах третьего ряда. Кроме того, металлоцентры с низким содержанием электронов подвергаются восстановительному элиминированию быстрее, чем металлоцентры с богатыми электронами, поскольку образующийся металл приобретает электронную плотность при восстановительном элиминировании. [8]
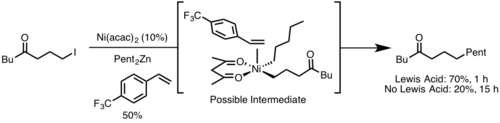
Восстановительное элиминирование обычно происходит быстрее из более стерически затрудненного металлического центра, поскольку стерическое препятствие уменьшается при восстановительном элиминировании. Кроме того, широкие углы прикусывания лиганда обычно ускоряют восстановительное элиминирование, поскольку стерические свойства заставляют элиминирующие группы сближаться друг с другом, что обеспечивает большее перекрытие орбиталей . [9]
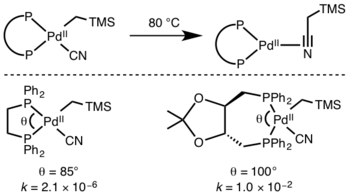
Кинетику восстановительного элиминирования трудно предсказать, но реакции с участием гидридов протекают особенно быстро из-за эффектов перекрытия орбиталей в переходном состоянии. [10]

Восстановительное элиминирование происходит быстрее для комплексов трех- или пятикоординационных металлцентров, чем для четырех- или шестикоординационных металлцентров. Для комплексов с четным координационным числом восстановительное элиминирование приводит к образованию промежуточного продукта с сильно разрыхляющей орбиталью металл-лиганд . Когда восстановительное элиминирование происходит из комплексов с нечетным координационным числом, образующееся промежуточное соединение занимает несвязывающую молекулярную орбиталь . [11]

Восстановительное элиминирование обычно происходит быстрее для комплексов, структура которых напоминает продукт. [2]
Восстановительное элиминирование можно вызвать путем окисления металлического центра до более высокой степени окисления с помощью света или окислителя. [12]
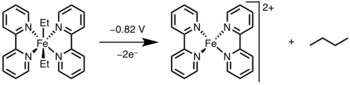
Восстановительное элиминирование нашло широкое применение в научных кругах и промышленности, наиболее примечательными из которых являются гидрирование , [13] процесс с уксусной кислотой Monsanto , [14] гидроформилирование , [15] и реакции кросс-сочетания . [16] Во многих из этих каталитических циклов восстановительное удаление является стадией образования продукта и регенерирует катализатор; однако в реакции Хека [17] и процессе Вакера [ 18] восстановительное отщепление участвует только в регенерации катализатора, поскольку продукты в этих реакциях образуются посредством отщепления β-гидрида .