В химии орбитальная гибридизация (или гибридизация ) — это концепция смешивания атомных орбиталей с образованием новых гибридных орбиталей (с разными энергиями, формами и т. д., чем составляющие атомные орбитали), подходящих для спаривания электронов с образованием химических связей в валентной связи. теория . Например, в атоме углерода, который образует четыре одинарные связи, s-орбиталь валентной оболочки соединяется с тремя p-орбиталями валентной оболочки, образуя четыре эквивалентные смеси sp 3 в тетраэдрическом расположении вокруг углерода, образуя связь с четырьмя различными атомами. Гибридные орбитали полезны для объяснения молекулярной геометрии и свойств атомных связей и симметрично расположены в пространстве. Обычно гибридные орбитали образуются путем смешивания атомных орбиталей сравнимых энергий. [1]
Химик Лайнус Полинг впервые разработал теорию гибридизации в 1931 году, чтобы объяснить структуру простых молекул , таких как метан (CH 4 ), с помощью атомных орбиталей . [2] Полинг указал, что атом углерода образует четыре связи, используя одну s- и три p-орбитали, так что «можно сделать вывод», что атом углерода будет образовывать три связи под прямым углом (с использованием p-орбиталей) и четвертую, более слабую. связь с использованием s-орбитали в произвольном направлении. На самом деле метан имеет четыре связи CH одинаковой силы. Угол между любыми двумя связями представляет собой тетраэдрический валентный угол 109°28' [3] (около 109,5°). Полинг предположил, что в присутствии четырех атомов водорода s- и p-орбитали образуют четыре эквивалентные комбинации, которые он назвал гибридными орбиталями. Каждый гибрид обозначается sp 3 для обозначения его состава и направлен вдоль одной из четырех связей CH. [4] Эта концепция была разработана для таких простых химических систем, но позже подход был применен более широко, и сегодня он считается эффективной эвристикой для рационализации структур органических соединений . Это дает простую орбитальную картину, эквивалентную структурам Льюиса .
Теория гибридизации является неотъемлемой частью органической химии , одним из наиболее убедительных примеров являются правила Болдуина . Для изображения механизмов реакции иногда необходима классическая картина связи, когда два атома имеют два общих электрона. [5] Теория гибридизации объясняет образование связей в алкенах [6] и метане. [7] Количество символов p или s, которое определяется главным образом орбитальной гибридизацией, может использоваться для надежного прогнозирования молекулярных свойств, таких как кислотность или основность. [8]
Орбитали представляют собой модель поведения электронов внутри молекул. В случае простой гибридизации это приближение основано на атомных орбиталях , аналогичных полученным для атома водорода, единственного нейтрального атома, для которого уравнение Шредингера может быть решено точно. В более тяжелых атомах, таких как углерод, азот и кислород, используются атомные орбитали 2s и 2p, аналогичные орбиталям возбужденного состояния водорода.
Предполагается, что гибридные орбитали представляют собой смеси атомных орбиталей, наложенных друг на друга в различных пропорциях. Например, в метане гибридная орбиталь C, которая образует каждую углерод - водородную связь, состоит на 25% из s-символа и на 75% из p-символа и поэтому описывается как гибридизованная sp3 ( читается как sp-три ). Квантовая механика описывает этот гибрид как волновую функцию sp 3 вида , где N — константа нормализации (здесь 1/2), а pσ — ар-орбиталь, направленная вдоль оси CH с образованием сигма-связи . Отношение коэффициентов (обычно обозначаемых λ) есть в этом примере. Поскольку плотность электронов , связанная с орбиталью, пропорциональна квадрату волновой функции, отношение p-символа к s-символу равно λ 2 = 3. Символ p или вес компонента p равен N 2 λ 2 = 3. /4.

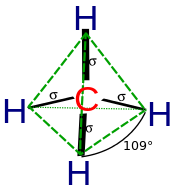
Гибридизация описывает соединение атомов с точки зрения атома. Для тетраэдрически координированного углерода (например, метана CH 4 ) углерод должен иметь 4 орбитали, направленные к 4 атомам водорода.
Конфигурация основного состояния углерода — 1s 2 2s 2 2p 2 или более легко читается:
Атом углерода может использовать свои две одиночно занятые орбитали p-типа для образования двух ковалентных связей с двумя атомами водорода, [ противоречиво ] с образованием синглетного метилена CH 2 , простейшего карбена . Атом углерода также может связываться с четырьмя атомами водорода путем возбуждения (или продвижения) электрона с дважды занятой 2s-орбитали на пустую 2p-орбиталь, образуя четыре одиночно занятые орбитали.
Энергия, выделяющаяся при образовании двух дополнительных связей, с лихвой компенсирует необходимую энергию возбуждения, энергетически благоприятствуя образованию четырех связей CH.
С квантовой механики наименьшая энергия получается, если четыре связи эквивалентны, что требует, чтобы они образовались из эквивалентных орбиталей углерода. Можно получить набор из четырех эквивалентных орбиталей, которые представляют собой линейные комбинации s- и p-волновых функций валентной оболочки (основные орбитали почти никогда не участвуют в связывании), [9] которые представляют собой четыре sp3 - гибрида.
В CH 4 четыре гибридные sp 3 орбитали перекрываются 1s-орбиталями водорода , образуя четыре σ (сигма) связи (то есть четыре одинарные ковалентные связи) одинаковой длины и силы.
Следующее :

переводится как:


Другие углеродные соединения и другие молекулы можно объяснить аналогичным образом. Например, этен (C 2 H 4 ) имеет двойную связь между атомами углерода.
Для этой молекулы углерод sp 2 гибридизуется, поскольку для двойной связи между атомами углерода необходима одна π (pi) связь , а на один атом углерода образуется только три σ связи. При гибридизации sp 2 орбиталь 2s смешивается только с двумя из трех доступных орбиталей 2p, обычно обозначаемых 2p x и 2p y . Третья 2p-орбиталь (2p z ) остается негибридизированной.
образуя в общей сложности три sp2 - орбитали с одной оставшейся p-орбиталью. В этилене два атома углерода образуют σ-связь, перекрывая одну sp 2- орбиталь каждого атома углерода. π-связь между атомами углерода, перпендикулярными плоскости молекулы, образуется путем перекрытия 2p–2p. Каждый атом углерода образует ковалентные связи C–H с двумя атомами водорода путем перекрытия s–sp 2 , все с валентными углами 120°. Все связи водород-углерод имеют одинаковую прочность и длину, что соответствует экспериментальным данным.

Химическая связь в таких соединениях, как алкины с тройными связями , объясняется sp-гибридизацией. В этой модели 2s-орбиталь смешана только с одной из трех p-орбиталей:
в результате чего образуются две sp-орбитали и две оставшиеся p-орбитали. Химическая связь в ацетилене (этине) (C 2 H 2 ) состоит из sp-sp перекрытия между двумя атомами углерода, образующими σ-связь, и двух дополнительных π-связей, образованных p-p-перекрыванием. Каждый углерод также связан с водородом в перекрытии σ s – sp под углами 180 °.

Гибридизация помогает объяснить форму молекулы , поскольку углы между связями примерно равны углам между гибридными орбиталями. Это контрастирует с теорией отталкивания электронных пар валентной оболочки (VSEPR) , которую можно использовать для предсказания молекулярной геометрии на основе эмпирических правил, а не теорий валентной связи или орбитальных теорий. [10]
Поскольку валентными орбиталями элементов основной группы являются одна s и три p-орбитали с соответствующим правилом октетов , для моделирования формы этих молекул используется sp x- гибридизация.
Поскольку валентными орбиталями переходных металлов являются пять d-, одна s- и три p-орбитали с соответствующим правилом 18 электронов , для моделирования формы этих молекул используется гибридизация sp x d y . Эти молекулы имеют тенденцию иметь несколько форм, соответствующих одной и той же гибридизации, из-за задействования разных d-орбиталей. Плоский квадратный комплекс имеет одну незанятую р-орбиталь и, следовательно, имеет 16 валентных электронов. [12]
В некоторых комплексах переходных металлов с низким числом d-электронов p-орбитали незаняты, и для моделирования формы этих молекул используется sd x- гибридизация. [11] [13] [12]
В некоторых учебниках по общей химии гибридизация представлена для координационного номера основной группы 5 и выше с использованием схемы «расширенного октета» с d-орбиталями, впервые предложенной Полингом. Однако сейчас такая схема считается некорректной в свете расчетов вычислительной химии.
В 1990 году Эрик Альфред Магнуссон из Университета Нового Южного Уэльса опубликовал статью, окончательно исключающую роль d-орбитальной гибридизации в связывании в гипервалентных соединениях элементов второго ряда ( период 3 ), положив конец спорам и путанице. Частично путаница возникает из-за того, что d-функции необходимы в базисных наборах, используемых для описания этих соединений (иначе это приводит к неоправданно высоким энергиям и искаженной геометрии). Кроме того, велик вклад d-функции в волновую функцию молекулы. Эти факты были неправильно интерпретированы как означающие, что в связывании должны участвовать d-орбитали. [14] [15]
В свете вычислительной химии лучшим решением было бы вызвать резонанс сигма-связи в дополнение к гибридизации, что означает, что каждая резонансная структура имеет свою собственную схему гибридизации. Все резонансные структуры должны подчиняться правилу октетов . [16]
В то время как простая модель орбитальной гибридизации обычно используется для объяснения формы молекул, гибридизация используется по-другому при расчете в современных программах валентных связей. В частности, гибридизация не определяется априори , а вместо этого вариационно оптимизируется для поиска решения с наименьшей энергией, а затем сообщается. Это означает, что все искусственные ограничения, в частности два ограничения, на орбитальную гибридизацию снимаются:
Это означает, что на практике гибридные орбитали не соответствуют простым идеям, которым обычно учат, и поэтому в научных статьях по вычислительным вычислениям их просто называют гибридами sp x , sp x d y или sd x , чтобы выразить их природу вместо более конкретных целочисленных значений.
Хотя идеальные гибридные орбитали могут быть полезны, в действительности для большинства связей требуются орбитали промежуточного характера. Это требует расширения, включающего гибкие взвешивания атомных орбиталей каждого типа (s, p, d) и позволяющего количественно описать образование связи, когда геометрия молекулы отклоняется от идеальных валентных углов. Количество p-символов не ограничивается целочисленными значениями; т.е. гибридизации, подобные sp 2.5 , также легко описаны.
Гибридизация орбиталей связи определяется правилом Бента : «Атомный характер концентрируется на орбиталях, направленных к электроположительным заместителям».
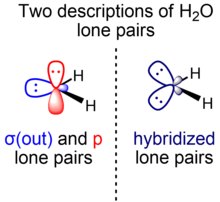
Для молекул с неподеленными парами связывающие орбитали представляют собой изовалентные sp x гибриды. Например, две гибридные орбитали кислорода в воде, образующие связи, можно описать как sp 4,0 , что дает межорбитальный угол 104,5°. [17] Это означает, что они имеют 20% s-характера и 80% p-характера, и не означает , что гибридная орбиталь образуется из одной s и четырех p-орбиталей кислорода, поскольку подоболочка кислорода 2p содержит только три p-орбитали.
Гибридизация s- и p-орбиталей для образования эффективных sp x- гибридов требует, чтобы они имели сопоставимую радиальную протяженность. В то время как 2p-орбитали в среднем менее чем на 10% больше, чем 2s, что отчасти объясняется отсутствием радиального узла на 2p-орбиталях, 3p-орбитали, имеющие один радиальный узел, превышают 3s-орбитали на 20–33%. [18] Разница в размерах s- и p-орбиталей увеличивается дальше по группе. Гибридизацию атомов в химических связях можно анализировать, рассматривая локализованные молекулярные орбитали, например, используя естественные локализованные молекулярные орбитали в схеме орбиталей естественной связи (NBO). В метане CH 4 расчетное соотношение p/s составляет примерно 3, что соответствует «идеальной» sp 3 гибридизации, тогда как для силана SiH 4 отношение p/s ближе к 2. Аналогичная тенденция наблюдается и для других 2p элементы. Замена водорода на фтор еще больше снижает отношение p/s. [19] Элементы 2p демонстрируют почти идеальную гибридизацию с ортогональными гибридными орбиталями. Для более тяжелых элементов p-блока это предположение об ортогональности не может быть оправдано. Эти отклонения от идеальной гибридизации Куцельнигг назвал дефектами гибридизации . [20]
Однако вычислительные группы VB, такие как Герратт, Купер и Раймонди (SCVB), а также Шайк и Хиберти (VBSCF), идут еще дальше и утверждают, что даже для модельных молекул, таких как метан, этилен и ацетилен, гибридные орбитали уже дефектны и неортогональный, с гибридизациями, такими как sp 1,76 вместо sp 3 для метана. [21]
Одно из заблуждений относительно орбитальной гибридизации состоит в том, что она неправильно предсказывает ультрафиолетовые фотоэлектронные спектры многих молекул. Хотя это верно, если теорема Купманса применяется к локализованным гибридам, квантовая механика требует, чтобы (в данном случае ионизированная) волновая функция подчинялась симметрии молекулы, что подразумевает резонанс в теории валентных связей. Например, в метане ионизированные состояния (CH 4 + ) могут быть построены из четырех резонансных структур, приписывающих выброшенный электрон каждой из четырех sp 3 -орбиталей. Линейная комбинация этих четырех структур, сохраняющая число структур, приводит к тройному вырожденному состоянию Т2 и состоянию А1 . [22] [23] Разница в энергии между каждым ионизированным состоянием и основным состоянием будет равна энергии ионизации , которая дает два значения в соответствии с экспериментальными результатами.
Связующие орбитали, образованные из гибридных атомных орбиталей, можно рассматривать как локализованные молекулярные орбитали, которые могут быть образованы из делокализованных орбиталей теории молекулярных орбиталей путем соответствующего математического преобразования. Для молекул в основном состоянии такая трансформация орбиталей оставляет неизменной общую многоэлектронную волновую функцию. Таким образом, гибридное орбитальное описание основного состояния эквивалентно делокализованному орбитальному описанию полной энергии и электронной плотности основного состояния, а также геометрии молекулы, которая соответствует минимальному значению полной энергии.
Молекулы с несколькими связями или несколькими неподеленными парами могут иметь орбитали, представленные в терминах сигма- и пи-симметрии, или эквивалентные орбитали. Различные методы валентных связей используют одно из двух представлений, которые имеют математически эквивалентные полные многоэлектронные волновые функции и связаны унитарным преобразованием набора занятых молекулярных орбиталей.
Для кратных связей представление сигма-пи является преобладающим по сравнению с эквивалентным орбитальным представлением ( изогнутая связь ). Напротив, для нескольких неподеленных пар в большинстве учебников используется эквивалентное орбитальное представление. Однако представление сигма-пи также используется, например, Вайнхольдом и Лэндисом в контексте естественных орбиталей связи , теории локализованных орбиталей, содержащей модернизированные аналоги классических (валентная связь / структура Льюиса) связывающих пар и неподеленных пар. [24] Например, для молекулы фторида водорода две неподеленные пары F представляют собой по существу негибридизованные p-орбитали, а другая представляет собой гибридную sp x -орбиталь. Аналогичное соображение применимо и к воде (одна неподеленная пара O находится на чистой p-орбитали, другая - на гибридной sp x- орбитали).