Этиленгликоль ( название ИЮПАК : этан-1,2-диол) — органическое соединение ( вицинальный диол [7] ) с формулой (CH 2 OH) 2 . Он в основном используется в двух целях: как сырье для производства полиэфирных волокон и для антифризов . Это бесцветная, легковоспламеняющаяся вязкая жидкость без запаха. Имеет сладкий вкус, но токсична в высоких концентрациях . Эта молекула была обнаружена в космосе. [8]
Этиленгликоль производится из этилена (этена) через промежуточный продукт оксид этилена . Окись этилена реагирует с водой , образуя этиленгликоль согласно химическому уравнению :
C 2 H 4 O + H 2 O → HO−CH 2 CH 2 −OH
Эта реакция может катализироваться кислотами или основаниями , или может происходить при нейтральном pH при повышенных температурах. Самый высокий выход этиленгликоля происходит при кислом или нейтральном pH с большим избытком воды. В этих условиях может быть достигнут выход этиленгликоля 90%. Основными побочными продуктами являются олигомеры диэтиленгликоль , триэтиленгликоль и тетраэтиленгликоль . Разделение этих олигомеров и воды является энергоемким. Мировое производство этиленгликоля составило ~20 Мт в 2010 году. [9]
Более высокая селективность достигается за счет использования процесса Shell OMEGA . В процессе OMEGA этиленоксид сначала преобразуется с помощью диоксида углерода (CO2 ) в этиленкарбонат . Затем это кольцо гидролизуется с помощью базового катализатора на втором этапе для получения моноэтиленгликоля с селективностью 98%. [10] Диоксид углерода снова выделяется на этом этапе и может быть возвращен в технологический контур. Диоксид углерода частично поступает из производства оксида этилена, где часть этилена полностью окисляется .
Этиленгликоль производится из оксида углерода в странах с большими запасами угля и менее строгими экологическими нормами. Окислительное карбонилирование метанола до диметилоксалата является перспективным подходом к производству C
1на основе этиленгликоля. [11] Диметилоксалат может быть преобразован в этиленгликоль с высоким выходом (94,7%) [12] путем гидрирования с медным катализатором: [13]
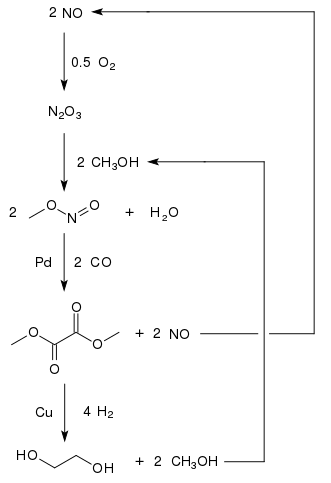
Поскольку метанол перерабатывается, потребляются только оксид углерода, водород и кислород. Один завод с производственной мощностью 200 000 тонн этиленгликоля в год находится во Внутренней Монголии , а второй завод в китайской провинции Хэнань с мощностью 250 000 тонн в год был запланирован на 2012 год. [14] По состоянию на 2015 год [обновлять]в Китае работали четыре завода с мощностью 200 000 тонн в год каждый, и еще как минимум 17 должны были последовать за ними. [15]
Этиленгликоль можно получить путем переработки его полимерных производных, таких как полиэтилентерефталат . [16]
Согласно большинству источников, французский химик Шарль-Адольф Вюрц (1817–1884) впервые получил этиленгликоль в 1856 году. [17] Сначала он обработал «этилениодид» ( C 2 H 4 I 2 ) ацетатом серебра, а затем гидролизовал полученный «этилендиацетат» гидроксидом калия . Вюрц назвал свое новое соединение «гликолем», потому что оно имело общие качества как с этиловым спиртом (с одной гидроксильной группой), так и с глицерином (с тремя гидроксильными группами). [18] В 1859 году Вюрц получил этиленгликоль путем гидратации окиси этилена . [ 19] Похоже, что до Первой мировой войны этиленгликоль не производился и не применялся в коммерческих целях , пока его не синтезировали из дихлорида этилена в Германии и не использовали в качестве заменителя глицерина в производстве взрывчатых веществ .
В Соединенных Штатах полукоммерческое производство этиленгликоля через этиленхлоргидрин началось в 1917 году. Первый крупный коммерческий завод по производству гликоля был построен в 1925 году в Саут-Чарльстоне, Западная Вирджиния , компанией Carbide and Carbon Chemicals Co. (теперь Union Carbide Corp.). К 1929 году этиленгликоль использовался почти всеми производителями динамита . В 1937 году компания Carbide запустила первый завод, основанный на процессе Лефорта для парофазного окисления этилена в оксид этилена. Carbide сохраняла монополию на процесс прямого окисления до 1953 года, когда процесс Scientific Design был коммерциализирован и предложен для лицензирования.
Основное применение этиленгликоля — в качестве антифриза в охлаждающей жидкости , например, в автомобилях и системах кондиционирования воздуха , которые либо размещают охладители или воздухообрабатывающие агрегаты снаружи, либо должны охлаждаться ниже температуры замерзания воды. В геотермальных системах отопления /охлаждения этиленгликоль — это жидкость , которая переносит тепло с помощью геотермального теплового насоса . Этиленгликоль либо получает энергию из источника (озеро, океан, скважина ), либо рассеивает тепло в стоке, в зависимости от того, используется ли система для отопления или охлаждения.
Чистый этиленгликоль имеет удельную теплоемкость примерно в два раза меньше, чем у воды. Таким образом, обеспечивая защиту от замерзания и повышенную температуру кипения, этиленгликоль снижает удельную теплоемкость водных смесей по сравнению с чистой водой. Смесь 1:1 по массе имеет удельную теплоемкость около 3140 Дж/(кг·°C) (0,75 БТЕ/(фунт·°F)), что составляет три четверти от удельной теплоемкости чистой воды, что требует увеличения расхода в сравнении с водой в той же системе.
Смесь этиленгликоля с водой обеспечивает дополнительные преимущества для охлаждающих жидкостей и антифризов, такие как предотвращение коррозии и кислотной деградации, а также подавление роста большинства микробов и грибков. [20] Смеси этиленгликоля и воды иногда неофициально называют в промышленности концентратами, соединениями, смесями или растворами гликоля.
Таблица тепловых и физических свойств насыщенного жидкого этиленгликоля: [21] [22]
Чистый этиленгликоль замерзает при температуре около −12 °C (10,4 °F), но при смешивании с водой смесь замерзает при более низкой температуре. Например, смесь 60% этиленгликоля и 40% воды замерзает при температуре −45 °C (−49 °F). [23] Диэтиленгликоль ведет себя аналогично. Понижение точки замерзания некоторых смесей можно объяснить коллигативным свойством растворов, но в высококонцентрированных смесях, таких как в примере, ожидаются отклонения от идеального поведения раствора из-за влияния межмолекулярных сил . Важно отметить, что хотя чистая и дистиллированная вода будет иметь большую удельную теплоемкость, чем любая смесь антифриза и воды, коммерческие антифризы также обычно содержат антикоррозионную добавку, чтобы предотвратить коррозию чистой водой каналов охлаждающей жидкости в блоке двигателя, головке(ах) цилиндров, водяном насосе и радиаторе.
Существует разница в соотношении смешивания, в зависимости от того, этиленгликоль это или пропиленгликоль. Для этиленгликоля соотношение смешивания обычно составляет 30/70 и 35/65, тогда как для пропиленгликоля соотношение смешивания обычно составляет 35/65 и 40/60. Важно, чтобы смесь была морозостойкой при самой низкой рабочей температуре. [24]
Из-за низких температур замерзания этиленгликоль используется в качестве антиобледенительной жидкости для стекол и самолетов, как антифриз в автомобильных двигателях, а также как компонент витрификационных (противокристаллизационных) смесей для низкотемпературной консервации биологических тканей и органов.
Использование этиленгликоля не только снижает температуру замерзания водных смесей, но и повышает их температуру кипения. Это приводит к расширению диапазона рабочих температур для теплоносителей на обоих концах температурной шкалы. Повышение температуры кипения обусловлено тем, что чистый этиленгликоль имеет гораздо более высокую температуру кипения и более низкое давление паров , чем чистая вода.

В пластмассовой промышленности этиленгликоль является важным предшественником полиэфирных волокон и смол . Полиэтилентерефталат , используемый для изготовления пластиковых бутылок для безалкогольных напитков , получают из этиленгликоля.
Этиленгликоль используется в газовой промышленности для удаления водяного пара из природного газа перед дальнейшей переработкой, во многом так же, как и триэтиленгликоль (ТЭГ).
Из-за высокой температуры кипения и сродства к воде этиленгликоль является полезным осушителем . Этиленгликоль широко используется для ингибирования образования клатратов (гидратов) природного газа в длинных многофазных трубопроводах, которые транспортируют природный газ из отдаленных газовых месторождений на газоперерабатывающий завод. Этиленгликоль может быть извлечен из природного газа и повторно использован в качестве ингибитора после очистки, которая удаляет воду и неорганические соли.
Природный газ обезвоживается этиленгликолем. В этом применении этиленгликоль стекает с верхней части башни и встречается с восходящей смесью водяного пара и углеводородных газов. Сухой газ выходит из верхней части башни. Гликоль и вода разделяются, а гликоль рециркулируется. Вместо удаления воды этиленгликоль также может использоваться для снижения температуры, при которой образуются гидраты . Чистота гликоля, используемого для подавления гидратов (моноэтиленгликоль), обычно составляет около 80%, тогда как чистота гликоля, используемого для дегидратации (триэтиленгликоль), обычно составляет от 95 до более чем 99%. Более того, скорость впрыска для подавления гидратов намного ниже скорости циркуляции в башне дегидратации гликоля .
Незначительные применения этиленгликоля включают производство конденсаторов, в качестве промежуточного химического вещества в производстве 1,4-диоксана , в качестве добавки для предотвращения коррозии в жидкостных системах охлаждения персональных компьютеров и внутри линзовых устройств электронно-лучевых трубок проекционных телевизоров. Этиленгликоль также используется в производстве некоторых вакцин , но сам по себе он не присутствует в этих инъекциях. Он используется как второстепенный (1–2%) ингредиент в креме для обуви , а также в некоторых чернилах и красителях. Этиленгликоль нашел некоторое применение в качестве средства для обработки древесины от гниения и грибка, как в качестве профилактики, так и для лечения после. В нескольких случаях он использовался для обработки частично сгнивших деревянных предметов, которые выставлялись в музеях. Это один из немногих методов обработки, которые успешно справляются с гнилью в деревянных лодках, и он относительно дешев. Этиленгликоль также может быть одним из второстепенных ингредиентов в растворах для очистки экранов, наряду с основным ингредиентом изопропиловым спиртом . Этиленгликоль обычно используется в качестве консерванта для биологических образцов, особенно в средних школах во время вскрытия , как более безопасная альтернатива формальдегиду . Он также используется как часть гидравлической жидкости на водной основе, используемой для управления подводным оборудованием для добычи нефти и газа.
Хотя этиленгликоль и не так широко используется в качестве предшественника полиэфиров , он полезен в более специализированных областях органической химии.
Он служит защитной группой в органическом синтезе для манипуляции кетонами и альдегидами. [25] [26] В одном примере изофорон был защищен с помощью этиленгликоля: [27]

Диоксалан, полученный из гликоля ацетоацетата этила, является коммерческим ароматизатором фруктоном . [28]
Диоксид кремния медленно растворяется в горячем этиленгликоле в присутствии щелочного металла, образуя силикаты. [29]
Этиленгликоль имеет относительно высокую токсичность для млекопитающих при приеме внутрь, примерно наравне с метанолом , с пероральной LD Lo = 786 мг/кг для человека. [30] Основная опасность связана с его сладким вкусом , который может привлекать детей и животных. При приеме внутрь этиленгликоль окисляется до гликолевой кислоты , которая, в свою очередь, окисляется до щавелевой кислоты , которая токсична . Он и его токсичные побочные продукты сначала поражают центральную нервную систему , затем сердце и, наконец, почки. Прием достаточного количества приводит к летальному исходу, если не лечить. [31] Ежегодно только в США регистрируется несколько случаев смерти. [32]
Доступны антифризы для автомобильного использования, содержащие пропиленгликоль вместо этиленгликоля. Они, как правило, считаются более безопасными в использовании, поскольку пропиленгликоль не так приятен на вкус [примечание 1] и преобразуется в организме в молочную кислоту , нормальный продукт метаболизма и физических упражнений. [35]
Австралия, Великобритания и семнадцать штатов США (по состоянию на 2012 год) требуют добавления горького ароматизатора ( денатониум бензоат ) в антифриз. В декабре 2012 года американские производители антифриза добровольно согласились добавлять горький ароматизатор во все антифризы, которые продаются на потребительском рынке США. [36]
В 2022 году несколько сотен детей умерли от острой почечной недостаточности в Индонезии и Гамбии , поскольку сироп парацетамола, произведенный базирующейся в Нью-Дели компанией Maiden Pharmaceuticals, содержал этиленгликоль и диэтиленгликоль — ингредиенты, которые связаны со смертностью детей от острой почечной недостаточности в Гамбии. [37] В декабре 2022 года министерство здравоохранения Узбекистана заявило, что дети умерли в результате этиленгликоля в сиропе от кашля , произведенном компанией Marion Biotech, которая базируется в Нойде , недалеко от Нью-Дели. [38]
Этиленгликоль — это химикат с большим объемом производства . Он распадается на воздухе примерно за 10 дней, а в воде или почве — за несколько недель. Он попадает в окружающую среду через рассеивание продуктов, содержащих этиленгликоль, особенно в аэропортах, где он используется в противообледенительных средствах для взлетно-посадочных полос и самолетов. [39] В то время как длительные низкие дозы этиленгликоля не проявляют токсичности, в дозах, близких к летальным (≥ 1000 мг/кг в день), этиленгликоль действует как тератоген . «На основании довольно обширной базы данных, он вызывает изменения скелета и пороки развития у крыс и мышей при всех путях воздействия». [40]
{{cite web}}: CS1 maint: бот: исходный статус URL неизвестен ( ссылка )(PDF; 5,4 МБ), Проспект 2011 г.{{cite book}}: CS1 maint: числовые имена: список авторов ( ссылка )