Гликосома – это закрытая мембраной органелла , содержащая гликолитические ферменты . Этот термин впервые был использован Скоттом и Стиллом в 1968 году после того, как они поняли, что гликоген в клетке является не статичной, а скорее динамической молекулой. [1] Он обнаружен у нескольких видов простейших, включая Kinetoplastida , которые включают подотряды Trypanosomatida и Bodonina, особенно в патогенных для человека трипаносомах , которые могут вызывать сонную болезнь , болезнь Шагаса и лейшманиоз . Органелла ограничена одной мембраной и содержит плотный белковый матрикс. Считается, что он произошел от пероксисомы . [2] Это было подтверждено исследованиями генетики Leishmania. [3]
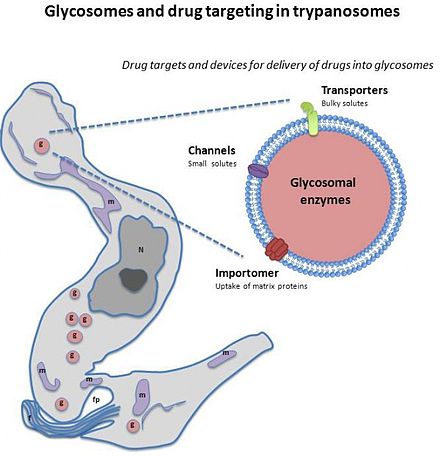
Гликосома в настоящее время исследуется как возможная мишень для лекарственной терапии.
Гликосомы уникальны для кинетопластид и их сестринских диплонемид . Термин гликосома также используется для обозначения гликогенсодержащих структур, обнаруженных в гепатоцитах , ответственных за хранение сахара, но они не являются мембраносвязанными органеллами. [4]
Гликосомы состоят из гликогена и белков. Белки представляют собой ферменты, которые участвуют в метаболизме гликогена. Эти белки и гликоген образуют комплекс, образующий отдельную органеллу. [1] Белки для гликосом импортируются из свободных цитозольных рибосом. Белки, импортированные в органеллу, имеют специфическую последовательность, заканчивающуюся последовательность PTS1, которая гарантирует, что они попадут в нужное место. [5] Они похожи на альфа-гранулы в цитозоле клетки, заполненные гликогеном. Гликосомы обычно имеют форму от круглой до овальной, размер каждой клетки варьируется. Хотя гликоген находится в цитоплазме, в гликосоме он находится отдельно, окруженный мембраной. Мембрана представляет собой липидный бислой. Гликоген, находящийся внутри гликосомы, идентичен гликогену, свободно находящемуся в цитозоле . [6] Гликосомы могут быть связаны или прикреплены ко многим различным типам органелл. Было обнаружено, что они прикреплены к саркоплазматической сети и ее промежуточным нитям. Было обнаружено, что другие гликосомы прикреплены к миофибриллам и митохондриям, шероховатой эндоплазматической сети, сарколемме, полирибосомам или аппарату Гольджи. Прикрепление гликосом может обеспечивать функциональное различие между ними; гликосомы, прикрепленные к миофибриллам, по-видимому, служат миозину , обеспечивая энергетические субстраты для генерации АТФ посредством гликолиза. Гликосомы шероховатой и гладкой эндоплазматической сети используют гликогенсинтазу и фосфорилазу-фосфатазы. [1]
Гликосомы участвуют во многих процессах в клетке. Эти процессы включают гликолиз, утилизацию пуринов , бета-окисление жирных кислот и синтез эфирных липидов. [5]
Основная функция, которую выполняет гликосома, — это гликолитический путь, который осуществляется внутри ее мембраны. Разделив гликолиз внутри гликосомы, клетка может добиться большего успеха . В клетке действие цитозоля, митохондрий и гликосомы завершает функцию энергетического обмена. Этот энергетический метаболизм генерирует АТФ в процессе гликолиза. Гликосома является хозяином основных гликолитических ферментов на пути гликолиза. Этот путь используется для расщепления жирных кислот с получением ими углерода и энергии. Однако весь процесс гликолиза не происходит в гликосоме. Скорее, только сегмент Эмбдена-Мейергофа, где глюкоза входит в гликосому. Важно отметить, что этот процесс в органелле не сопровождается чистым синтезом АТФ. Этот АТФ поступает позже из процессов за пределами гликосомы. Внутри гликосомы для функционирования и регенерации необходим НАД+ . Фруктозо-1,6-бифосфат используется в гликосомах как способ получения окислителей, способствующих началу гликолиза. Гликосома превращает сахар в 3-фосфоглицерат. [2]
Другая функция гликосом – спасение пурина. Паразиты, в клетках которых присутствуют гликосомы, не могут производить пурины de novo. Этот пурин, вырабатываемый в гликосоме, затем экспортируется из гликосомы для использования в клетке в виде нуклеиновой кислоты. В других клетках ответственные за это ферменты присутствуют в цитозоле. Этими ферментами, обнаруженными в гликосоме и помогающими в синтезе, являются гуанин- и аденин-фосфорибозилтрансфераза, гипоксантин и ксантинфоторан. Все эти ферменты содержат последовательность PTS1 в карбоксильной последовательности, поэтому они направляются в гликосому. [5]
Микроскопические методы позволили многое узнать о гликосоме в клетке и действительно доказали, что в клетке существует мембраносвязанная органелла, содержащая гликоген и его процессы. Результаты Пауля Эрлиха, сделанные еще в 1883 году, показали, что с помощью микроскопа он мог сказать, что гликоген в клетке всегда находится с тем, что он назвал переносчиком, который, как позже стало известно, был белком. Сам гликоген также всегда наблюдался в клетке по направлению к нижнему полюсу в одной группе, фиксированный. Когда ученые попытались окрасить то, что считалось простыми молекулами гликогена, окрашивание дало разные результаты. Это связано с тем, что это были не свободные молекулы гликогена, а гликосомы. Гликосому изучали в микроскоп, исследуя гликосому, окрашенную уранилацетатом . Окрашенный U/Pb представлял собой белок, входящий в состав гликосомы. Гликоген в гликосомах клеток обычно связан с белком, масса которого в два-четыре раза превышает массу гликогена. Однако сам гликоген после очистки обнаруживается с очень небольшим количеством белка, обычно менее трех процентов, что показывает, что гликосома ответственна и функционирует, имея в гликосоме белки и ферменты, необходимые для гликогена. При окрашивании уранилом, как и кислотой, он вызывает диссоциацию белка от гликогена. Гликоген без белка будет образовывать большие агрегаты, а пятном будет белок. Это создает иллюзию исчезновения гликогена, поскольку он не окрашивается, но диссоциирует от белка, с которым он обычно связан в гликосоме. [1]
Биохимически было обнаружено множество доказательств того, что гликосомы присутствуют в клетках. В органелле, которая считается гликосомой, обнаружено множество белков. К ним относятся гликогенсинтаза, фосфорилаза, а также ферменты ветвления и разветвления гликогена. Все это регуляторные ферменты , необходимые для синтеза гликогена. Для инициации синтеза гликогена необходим гликогенин , обнаруженный в гликосомах, белковый праймер. Гликогенсинтаза, как уже упоминалось, способствует удлинению гликогена, а удалению глюкозы из гликогена способствуют разветвляющие ферменты и фосфорилаза . Все эти ферменты обнаружены в гликосоме, что указывает на то, что эта органелла, содержащая гликоген, также отвечает за хранение гликогена и отделена от цитозоля. [1]
Есть два типа гликосом, которые обнаруживаются в клетках, имеющих эти специализированные органеллы. Эти две группы представляют собой лиогликосомы и десмогликосомы. Они различаются своей ассоциацией с другими органеллами клетки, а также их относительной численностью. Исследования показали, что здоровые клетки содержат больше лиогликосом, тогда как голодные клетки имеют больше десмогликосом.
Лиогликосомы – это гликосомы, находящиеся в свободном состоянии в цитозоле клетки. На эти типы гликосом влияет кислота. Они, как правило, менее электронноплотны, чем гликосомы другого типа. Лиогликосомы также обычно встречаются в виде цепочек в цитозоле. Поскольку лиогликосомы не связаны с тканями, их можно экстрагировать кипящей водой. [1]
Десмогликосомы не находятся в цитозоле свободно, а находятся вместе с другими органеллами или структурами клетки. Эти структуры относятся к другим упомянутым органеллам, таким как миофибриллы, митохондрии и эндоплазматический ретикулум. Это объясняет, почему десмогликосомы обнаруживаются в мышечных клетках . Эти гликосомы не подвергаются воздействию кислоты. Обнаружено, что эти гликосомы не образуют группы, а остаются отдельными как отдельные органеллы. Из-за большого количества белка, с которым связывается гликосома, обычно наблюдается высокая электронная плотность. Десмогликосомы невозможно извлечь из кипящей воды, поскольку они связываются с тканями посредством связи с белком. [1]
Гликосомы являются наиболее разными из различных типов органелл, происходящих из пероксисом, особенно это видно в трипаносомах . Пероксисомы высших эукариот очень похожи на гликосомы и глиоксисомы , обнаруженные у некоторых растений и грибов. Гликосома имеет ту же структуру базового уровня: одну мембрану и очень плотный белковый матрикс. Некоторые исследования показали, что некоторые ферменты и пути, обнаруженные в пероксисоме, также наблюдаются в гликосомах некоторых видов трипаносом. Кроме того, нацеливающие последовательности белков, которые отправляются в гликосому для белковой матрицы, аналогичны последовательности последовательностей белков, импортируемых в пероксисому. То же самое наблюдается в реальных последовательностях белков, входящих в матрицы этих двух органелл, а не только в направляющих последовательностях. Было высказано предположение, что с тех пор, как было обнаружено, что гликосомы обладают пластидоподобными белками, давно произошел боковой перенос генов от организма, способного к фотосинтезу, гены которого были перенесены, чтобы получить полученные пероксисомы и гликосомы. Сама гликосома, как и пероксисома, лишена генома . [2]
В отличие от пероксисом, для выживания большинства трипаносом необходимы гликосомы. Из-за этой потребности в гликосоме в качестве возможной мишени для лекарства было предложено найти лекарство , останавливающее ее функцию. Когда гликосома не функционирует правильно, в клетке наблюдается серьезная нехватка ферментов. Эти ферменты связаны с синтезом эфирных липидов или бета-окислением некоторых жирных кислот. Клетки без гликосом испытывают дефицит этих ферментов, поскольку без компартментализации гликосом ферменты разрушаются в клетке в цитозоле. Органелла препятствует метаболизму ферментов. Для паразитов синтез эфирных липидов жизненно важен для завершения жизненного цикла, поэтому ферменты, защищенные гликосомой, также жизненно важны. [2] В их жизненном цикле гликолиз, частично через гликосому, очень высок в форме кровотока по сравнению с проциклической формой. Путь гликосомального гликолиза необходим в стрессовых ситуациях для патогена, поскольку гликолиз может быть запущен, когда субстраты для этого пути доступны, даже когда АТФ еще не доступен. Поскольку эта органелла настолько важна для трипаносомы, если бы лекарство могло воздействовать на эту органеллу, это могло бы стать успешной терапией, как показали исследования, без гибели гликосомного паразита. [7]