В координационной химии координатная ковалентная связь , [1] также известная как дативная связь , [2] диполярная связь , [1] или координатная связь [3] представляет собой разновидность двухцентровой двухэлектронной ковалентной связи , в которой два электрона происходят от одного и того же атома . Соединение ионов металлов с лигандами предполагает именно такое взаимодействие. [4] Этот тип взаимодействия занимает центральное место в кислотно-основной теории Льюиса .
Координационные связи обычно встречаются в координационных соединениях . [5]

Координатная ковалентная связь распространена повсеместно. [6] Во всех аквакомплексах металлов [M(H 2 O) n ] m + связь между водой и катионом металла описывается как координатная ковалентная связь. Аналогично описываются металл-лигандные взаимодействия в большинстве металлоорганических соединений и большинстве координационных соединений .
Термин «диполярная связь» используется в органической химии для таких соединений, как оксиды аминов , электронная структура которых может быть описана в терминах основного амина , отдающего два электрона атому кислорода.
Стрелка → указывает, что оба электрона связи происходят от аминного фрагмента . В стандартной ковалентной связи каждый атом отдает один электрон. Следовательно, альтернативное описание состоит в том, что амин отдает один электрон атому кислорода, который затем используется вместе с оставшимся неспаренным электроном на атоме азота для образования стандартной ковалентной связи. Процесс передачи электрона от азота к кислороду создает формальные заряды , поэтому электронную структуру можно также изобразить как
Эта электронная структура имеет электрический диполь , отсюда и название полярная связь. В действительности атомы несут частичные заряды ; более электроотрицательный атом из двух, участвующих в связи, обычно несет частичный отрицательный заряд. Единственным исключением из этого правила является окись углерода . В этом случае атом углерода несет частичный отрицательный заряд, хотя он менее электроотрицательен, чем кислород.
Примером дативной ковалентной связи является взаимодействие между молекулой аммиака , основанием Льюиса с неподеленной парой электронов на атоме азота, и трифторидом бора , кислотой Льюиса , поскольку атом бора имеет неполный октет электроны. При образовании аддукта атом бора приобретает октетную конфигурацию.
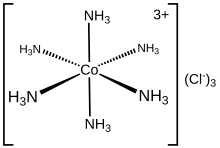
Электронную структуру координационного комплекса можно описать набором лигандов, каждый из которых отдает пару электронов металлическому центру. Например, в хлориде гексамминкобальта(III) каждый аммиачный лиганд отдает свою неподеленную пару электронов иону кобальта(III). В этом случае образующиеся связи называются координатными. В методе классификации ковалентных связей (CBC) лиганды, которые образуют координационные ковалентные связи с центральным атомом, классифицируются как L-тип, а те, которые образуют нормальные ковалентные связи, классифицируются как X-тип.
Во всех случаях связь, будь то дативная или «нормальная» с общим электроном, является ковалентной связью. В обычном использовании префикс диполярный, дательный или координатный просто служит для указания происхождения электронов, используемых при создании связи. Например, F 3 B ← O(C 2 H 5 ) 2 (« (диэтил)эфират трифторида бора ») получают из BF 3 и : O(C 2 H 5 ) 2 , в отличие от радикальной разновидности [•BF 3 ] – и [•O(C 2 H 5 ) 2 ] + . Дательная связь также удобна с точки зрения обозначений, поскольку позволяет избежать формальных обвинений: мы можем писать D : + []A ⇌ D → A, а не D + –A – (здесь : и [] обозначают неподеленную пару и пустая орбиталь донора электронной пары D и акцептора A соответственно). Это обозначение иногда используется даже тогда, когда рассматриваемая кислотно-основная реакция Льюиса является лишь условной (например, сульфоксид R 2 S → O редко, если вообще когда-либо, образуется путем реакции сульфида R 2 S с атомарным кислородом O). Таким образом, большинство химиков не делают никаких заявлений относительно свойств связи при выборе одного обозначения вместо другого (формальные заряды вместо стрелочной связи).
Однако в целом верно, что связи, изображенные таким образом, являются полярно-ковалентными, иногда сильно, и некоторые авторы утверждают, что существуют реальные различия в свойствах дативной связи и связи с общим электроном, и предполагают, что показывать дативную связь более важно. уместно в конкретных ситуациях. Еще в 1989 году Хааланд охарактеризовал дативные облигации как облигации, которые (i) являются слабыми и длинными; (ii) при образовании связи происходит лишь небольшая степень переноса заряда; и (iii) предпочтительный способ диссоциации которого в газовой фазе (или инертном растворителе с низким ε) является гетеролитическим, а не гомолитическим. [7] В качестве классического примера приведен аммиачно-борановый аддукт (H 3 N → BH 3 ): связь слабая, с энергией диссоциации 31 ккал/моль (ср. 90 ккал/моль для этана), и длительная , в 166 пм (ср. 153 пм для этана), а молекула обладает дипольным моментом 5,2 Д, что предполагает передачу всего 0,2 е – от азота к бору. По оценкам , гетеролитическая диссоциация H 3 N → BH 3 требует 27 ккал/моль, что подтверждает, что гетеролиз с образованием аммиака и борана более выгоден, чем гомолиз с образованием катион-радикала и анион-радикала. Однако, помимо четких примеров, существуют серьезные споры относительно того, когда квалифицируется конкретное соединение и, следовательно, об общей распространенности дативной связи (по отношению к предпочтительному определению автора). Химики-вычислители предложили количественные критерии, позволяющие различать два «типа» связей. [8] [9] [10]
Некоторые неочевидные примеры, когда дативная связь считается важной, включают субоксид углерода (O≡C → C 0 ← C≡O), тетрааминоаллены (описываемые на языке дативной связи как «карбодикарбены»; (R 2 N) 2 C → C 0 ← C(NR 2 ) 2 ), карбодифосфоран Рамиреса (Ph 3 P → C 0 ← PPh 3 ) и катион бис(трифенилфосфин)иминия (Ph 3 P → N + ← PPh 3 ), все из которых демонстрируют значительную изогнутость. равновесные геометрии, хотя и с неглубоким барьером для изгиба. Простое применение обычных правил рисования структур Льюиса путем максимизации связей (с использованием связей с общим электроном) и минимизации формальных зарядов могло бы предсказать гетерокумуленовые структуры и, следовательно, линейную геометрию для каждого из этих соединений. Таким образом, утверждается, что эти молекулы лучше моделируются как координационные комплексы : C : (углерод(0) или карбон ) или : N : + (катион моноазота) с CO, PPh 3 или N- гетероциклическими карбенами в качестве лигандов, одиноких пары на центральном атоме, отвечающие за изогнутую геометрию. Однако полезность этой точки зрения оспаривается. [9] [10]