В химии декарбонилирование — это тип органической реакции , которая включает потерю окиси углерода (CO). Часто это нежелательная реакция, поскольку она представляет собой деградацию . В химии карбонилов металлов декарбонилирование описывает процесс замещения , при котором лиганд CO заменяется другим лигандом.
В отсутствие металлических катализаторов декарбонилирование (по сравнению с декарбоксилированием ) в органической химии наблюдается редко . Единственным исключением является декарбонилирование муравьиной кислоты :
Реакцию вызывает серная кислота , которая действует как катализатор и дегидратирующий агент. В ходе этой реакции муравьиная кислота иногда используется в качестве источника CO в лаборатории вместо баллонов с этим токсичным газом. [1] При сильном нагревании муравьиная кислота и некоторые ее производные могут подвергаться декарбонилированию даже без добавления катализатора. Например, диметилформамид ( (CH 3 ) 2 NC(O)H ) при нагревании до температуры кипения (154 °C) медленно разлагается с образованием диметиламина и монооксида углерода . Некоторые производные муравьиной кислоты, такие как формилхлорид ( -COCl ), подвергаются спонтанному декарбонилированию при комнатной температуре (или ниже).
Реакции с участием оксалилхлорида (COCl) 2 (например, гидролиз , реакция с карбоновыми кислотами, окисление Сверна и т. д.) часто приводят к высвобождению как диоксида углерода, так и монооксида углерода посредством процесса фрагментации.
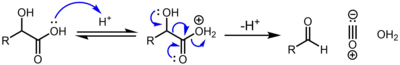
α-Оксикислоты , например ( молочная кислота и гликолевая кислота ), подвергаются декарбонилированию при обработке каталитической концентрированной серной кислотой по следующему механизму: [2]
Силакарбоновые кислоты ( R 3 SiCOOH ) подвергаются декарбонилированию при нагревании или обработке основанием и были исследованы как молекулы, генерирующие оксид углерода. [3] [4]
Обычное преобразование включает превращение альдегидов в алканы . [5]
Декарбонилирование может катализироваться растворимыми металлокомплексами. [6] [5] Эти реакции протекают через посредничество ацилгидридов металлов . Примером этого является реакция декарбонилирования Цудзи-Уилкинсона с использованием катализатора Уилкинсона . (Строго говоря, некаталитический вариант этой реакции приводит к образованию карбонильного комплекса родия, а не свободного монооксида углерода.) Эту реакцию обычно проводят в небольших масштабах в ходе полного синтеза сложного природного продукта, поскольку, хотя эта реакция очень эффективен при слегка повышенных температурах (например, 80 °C), когда используется стехиометрический родий, оборот катализатора посредством экструзии CO требует диссоциации очень стабильного карбонильного комплекса родия, и требуются температуры, превышающие 200 °C. Это преобразование имеет значение в органическом синтезе , где декарбонилирование является редкой реакцией.

Декарбонилирование представляет интерес для превращений сахаров. [7] Кетоны и другие карбонилсодержащие функциональные группы более устойчивы к декарбонилированию, чем альдегиды.
Некоторые циклические молекулы , содержащие кетон, подвергаются хелетропной реакции экструзии , в результате чего в оставшейся структуре остаются новые углерод-углеродные π-связи . Эта реакция может протекать самопроизвольно, как при синтезе гексафенилбензола . Циклопеноны и циклобутендионы можно превратить в алкины путем отщепления одной или двух молекул CO соответственно. [8]
Оксид углерода выделяется при распаде (катаболизме) гема под действием О 2 , НАДФН и фермента гемоксигеназы : [9]
Многие карбонилы металлов получают реакциями декарбонилирования. Лиганд CO в комплексе Васки возникает в результате декарбонилирования диметилформамида :
Превращение Fe(CO) 5 и Mo(CO) 6 в их многочисленные производные часто включает декарбонилирование. Здесь декарбонилирование сопровождает получение димера дикарбонила циклопентадиенилирона :
Декарбонилирование можно вызвать фотохимически, а также с использованием таких реагентов, как N -оксид триметиламина :