В химии молекула испытывает напряжение , когда ее химическая структура подвергается некоторому напряжению , которое повышает ее внутреннюю энергию по сравнению с эталонным соединением без напряжения . Внутренняя энергия молекулы состоит из всей энергии , запасенной внутри нее. Напряженная молекула имеет дополнительное количество внутренней энергии, которого нет у ненапряженной молекулы. Эту дополнительную внутреннюю энергию, или энергию напряжения , можно сравнить со сжатой пружиной . [1] Подобно тому, как сжатая пружина должна удерживаться на месте, чтобы предотвратить высвобождение ее потенциальной энергии , молекула может удерживаться в энергетически невыгодной конформации связями внутри этой молекулы. Без связей, удерживающих конформацию на месте, энергия напряжения высвобождалась бы.
Равновесие двух молекулярных конформаций определяется разницей в свободной энергии Гиббса двух конформаций. Из этой разности энергий можно определить константу равновесия для двух конформаций.
Если происходит уменьшение свободной энергии Гиббса из одного состояния в другое, это преобразование является спонтанным , и состояние с более низкой энергией является более стабильным . Сильно напряженная молекулярная конформация с более высокой энергией спонтанно преобразуется в молекулярную конформацию с более низкой энергией.

Энтальпия и энтропия связаны со свободной энергией Гиббса через уравнение (при постоянной температуре ):
Энтальпия обычно является более важной термодинамической функцией для определения более стабильной молекулярной конформации. [1] Хотя существуют различные типы деформации, энергия деформации, связанная со всеми из них, обусловлена ослаблением связей внутри молекулы. Поскольку энтальпия обычно важнее, энтропию часто можно игнорировать. [1] Это не всегда так; если разница в энтальпии мала, энтропия может оказывать большее влияние на равновесие. Например, н-бутан имеет две возможные конформации: анти и гош . Анти-конформация более стабильна на 0,9 ккал моль −1 . [1] Мы ожидаем, что бутан примерно на 82% анти и на 18% гош при комнатной температуре. Однако существуют две возможные гош-конформации и только одна анти-конформация. Следовательно, энтропия вносит вклад в размере 0,4 ккал в пользу гош-конформации. [2] Мы обнаружили, что фактическое конформационное распределение бутана составляет 70% анти и 30% гош при комнатной температуре.

Стандартная теплота образования (Δ f H °) соединения описывается как изменение энтальпии при образовании соединения из его отдельных элементов. [3] Когда теплота образования соединения отличается либо от прогнозируемого, либо от эталонного соединения, это различие часто можно отнести к деформации. Например, Δ f H ° для циклогексана составляет -29,9 ккал моль -1 , а Δ f H ° для метилциклопентана составляет -25,5 ккал моль -1 . [1] Несмотря на то, что у метилциклопентана одинаковые атомы и количество связей, энергия метилциклопентана выше, чем у циклогексана. Эту разницу в энергии можно отнести к деформации кольца из пяти членов, которая отсутствует в циклогексане. Экспериментально энергия деформации часто определяется с использованием теплот сгорания , что обычно является простым экспериментом.
Определение энергии деформации внутри молекулы требует знания ожидаемой внутренней энергии без деформации. Есть два способа сделать это. Во-первых, можно сравнить с похожим соединением, в котором отсутствует деформация, например, в предыдущем примере с метилциклогексаном . К сожалению, часто бывает трудно получить подходящее соединение. Альтернативой является использование теории приращения группы Бенсона . Пока для атомов внутри соединения доступны подходящие приращения группы, можно сделать прогноз Δ f H °. Если экспериментальное Δ f H ° отличается от предсказанного Δ f H °, эту разницу в энергии можно отнести к энергии деформации.
Напряжение Ван-дер-Ваальса , или стерическое напряжение, возникает, когда атомы вынуждены приближаться друг к другу больше, чем позволяют их радиусы Ван-дер-Ваальса . [4] : 5 В частности, напряжение Ван-дер-Ваальса считается формой напряжения, при которой взаимодействующие атомы находятся на расстоянии не менее четырех связей друг от друга. [5] Величина стерического напряжения в подобных молекулах зависит от размера взаимодействующих групп; объемные трет-бутильные группы занимают гораздо больше места, чем метильные группы , и часто испытывают более сильные стерические взаимодействия.
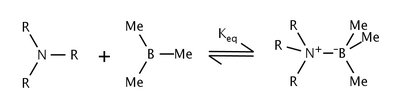
Эффекты стерического напряжения в реакции триалкиламинов и триметилбора были изучены лауреатом Нобелевской премии Гербертом С. Брауном и др. [6]. Они обнаружили, что по мере увеличения размера алкильных групп амина константа равновесия также уменьшалась. Сдвиг равновесия был приписан стерическому напряжению между алкильными группами амина и метильными группами бора.
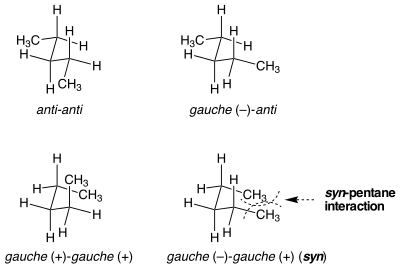
Существуют ситуации, когда, казалось бы, идентичные конформации не равны по энергии напряжения. Син-пентановое напряжение является примером такой ситуации. Существует два разных способа поместить обе связи, центральные в н -пентане , в гош-конформацию, одна из которых на 3 ккал моль −1 выше по энергии, чем другая. [1] Когда две метилзамещенные связи вращаются из анти в гош в противоположных направлениях, молекула принимает циклопентаноподобную конформацию, в которой две концевые метильные группы сближаются. Если связи вращаются в одном направлении, этого не происходит. Стерическое напряжение между двумя концевыми метильными группами объясняет разницу в энергии между двумя похожими, но очень разными конформациями.

Аллильный штамм, или штамм A 1,3 , тесно связан с син-пентановым штаммом. Пример аллильного штамма можно увидеть в соединении 2-пентен . Этильный заместитель олефина может вращаться таким образом, что конечная метильная группа приближается к соседней метильной группе олефина. Эти типы соединений обычно принимают более линейную конформацию, чтобы избежать стерического напряжения между заместителями. [1]
1,3-диаксиальное напряжение является другой формой напряжения, похожей на син-пентан. В этом случае напряжение возникает из-за стерических взаимодействий между заместителем циклогексанового кольца ('α') и гош-взаимодействий между альфа-заместителем и обоими метиленовыми углеродами на расстоянии двух связей от рассматриваемого заместителя (отсюда 1,3-диаксиальные взаимодействия). [4] : 10 Когда заместитель является аксиальным , он приближается к аксиальному гамма-водороду. Величина напряжения во многом зависит от размера заместителя и может быть уменьшена путем формирования в основную конформацию кресла, помещая заместитель в экваториальное положение. Разница в энергии между конформациями называется значением A и хорошо известна для многих различных заместителей. Значение A является термодинамическим параметром и первоначально измерялось вместе с другими методами, использующими уравнение свободной энергии Гиббса и, например, равновесие восстановления Меервейна–Понндорфа–Верлея / окисления Оппенауэра для измерения аксиальных и экваториальных значений циклогексанона/циклогексанола (0,7 ккал моль −1 ). [7]
Деформация кручения — это сопротивление скручиванию связей. В циклических молекулах ее также называют деформацией Питцера .
Торсионная деформация возникает, когда атомы, разделенные тремя связями, помещаются в заслоненную конформацию вместо более стабильной ступенчатой конформации. Барьер вращения между ступенчатой конформацией этана составляет приблизительно 2,9 ккал моль −1 . [1] Первоначально считалось, что барьер вращения обусловлен стерическими взаимодействиями между соседними атомами водорода, но радиус Ван-дер-Ваальса водорода слишком мал, чтобы это было так. Недавние исследования показали, что ступенчатое положение может быть более стабильным из-за гиперконъюгативного эффекта . [8] Вращение от ступенчатой конформации прерывает эту стабилизирующую силу.
Более сложные молекулы, такие как бутан, имеют более одной возможной ступенчатая конформация. Анти-конформация бутана примерно на 0,9 ккал моль −1 (3,8 кДж моль −1 ) более стабильна, чем гош-конформация. [1] Обе эти ступенчатые конформации намного стабильнее, чем заслоненные конформации. Вместо гиперконъюгативного эффекта, такого как в этане , энергия деформации в бутане обусловлена как стерическими взаимодействиями между метильными группами , так и угловой деформацией, вызванной этими взаимодействиями.
Согласно теории молекулярной связи VSEPR , предпочтительная геометрия молекулы — это та, в которой как связывающие, так и несвязывающие электроны находятся как можно дальше друг от друга. В молекулах довольно часто эти углы несколько сжаты или расширены по сравнению с их оптимальным значением. Эта деформация называется угловой деформацией или деформацией Байера. [9] Простейшими примерами угловой деформации являются небольшие циклоалканы, такие как циклопропан и циклобутан, которые обсуждаются ниже. Кроме того, в циклических системах часто наблюдается затмение или деформация Питцера . Эти и возможные трансаннулярные взаимодействия были ранее обобщены Х. К. Брауном как внутренняя деформация или I-деформация. [10] Молекулярная механика или подходы силового поля позволяют рассчитать такие вклады деформации, которые затем можно соотнести, например, со скоростями реакций или равновесиями. Многие реакции алициклических соединений, включая равновесия, окислительно-восстановительные реакции и реакции сольволиза, которые все характеризуются переходом между состояниями sp2 и sp3 в реакционном центре, коррелируют с соответствующими разностями энергии деформации SI (sp2 -sp3). [11] Данные отражают в основном неблагоприятные вицинальные углы в средних кольцах, как показано сильным увеличением скоростей восстановления кетона с увеличением SI (рисунок 1). Другим примером является сольволиз мостиковых тозилатов с разницей стерической энергии между соответствующими производными бромида (sp3) и ионом карбения в качестве sp2-модели для переходного состояния . [12] (рисунок 2)


В принципе, угловая деформация может возникать в ациклических соединениях, но это явление встречается редко.
Циклогексан считается эталоном при определении кольцевой деформации в циклоалканах, и общепринято, что энергия деформации мала или отсутствует. [1] Для сравнения, меньшие циклоалканы имеют гораздо большую энергию из-за повышенной деформации. Циклопропан аналогичен треугольнику и, таким образом, имеет углы связи 60°, что намного ниже предпочтительных 109,5° гибридизированного углерода sp 3. Кроме того, водороды в циклопропане затенены. Циклобутан испытывает похожую деформацию с углами связи приблизительно 88° (он не полностью плоский) и затененными водородами. Энергия деформации циклопропана и циклобутана составляет 27,5 и 26,3 ккал моль −1 соответственно. [1] Циклопентан испытывает гораздо меньшую деформацию, в основном из-за крутильной деформации от затененных водородов: его предпочтительные конформации взаимопревращаются в процессе, называемом псевдовращением . [4] : 14
Напряжение кольца может быть значительно выше в бициклических системах . Например, бициклобутан , C 4 H 6 , известен как одно из наиболее напряженных соединений, которое можно выделить в больших масштабах; его энергия напряжения оценивается в 63,9 ккал моль −1 (267 кДж моль −1 ). [13] [14]
Кольца среднего размера (7–13 атомов углерода) испытывают большую энергию деформации, чем циклогексан, в основном из-за отклонения от идеальных вицинальных углов или деформации Питцера. Молекулярно-механические расчеты показывают, что трансаннулярная деформация, также известная как деформация Прелога , не играет существенной роли. Однако трансаннулярные реакции, такие как 1,5-сдвиги в реакциях замещения циклооктана, хорошо известны.
Количество энергии деформации в бициклических системах обычно равно сумме энергии деформации в каждом отдельном кольце. [1] Это не всегда так, поскольку иногда слияние колец вызывает некоторую дополнительную деформацию.
В синтетических аллостерических системах обычно есть два или более конформеров с различиями в стабильности из-за вкладов деформации. Положительная кооперативность, например, возникает из-за повышенного связывания субстрата A с конформером C2, которое производится связыванием эффекторной молекулы E. Если конформер C2 имеет такую же стабильность, как и другой уравновешивающий конформер C1, подгонка, вызванная субстратом A, приведет к связыванию A с C2 также в отсутствие эффектора E. Только если стабильность конформера C2 значительно меньше, что означает, что в отсутствие эффектора E популяция C2 намного меньше, чем у C1, отношение K2/K1, которое измеряет эффективность аллостерического сигнала, увеличится. Отношение K2/K1 может быть напрямую связано с разницей энергии деформации между конформерами C1 и C2; если оно мало, более высокие концентрации A будут напрямую связываться с C2 и делать эффектор E неэффективным. Кроме того, время отклика таких аллостерических переключателей зависит от напряжения состояния переходов взаимопревращения конформера. [15]