Этан ( США : / ˈ ɛ θ eɪ n / ETH -ayn , Великобритания : / ˈ iː -/ EE - ) — встречающееся в природе органическое химическое соединение с химической формулой C.
2ЧАС
6. При стандартной температуре и давлении этан представляет собой бесцветный газ без запаха . Как и многие углеводороды , этан выделяют в промышленных масштабах из природного газа и как нефтехимический побочный продукт переработки нефти . Его основное применение — в качестве сырья для производства этилена .
Родственные соединения могут быть образованы путем замены атома водорода другой функциональной группой ; этановый фрагмент называется этильной группой . Например, этильная группа, связанная с гидроксильной группой, дает этанол , алкоголь в напитках .
Этан был впервые синтезирован в 1834 году Майклом Фарадеем , применив электролиз раствора ацетата калия . Он принял углеводородный продукт этой реакции за метан и не стал его исследовать дальше. [5]
В период 1847–1849 годов, стремясь доказать радикальную теорию органической химии , Герман Кольбе и Эдвард Франкланд получили этан путем восстановления пропионитрила ( этилцианида ) [6] и этилиодида [7] металлическим калием , и, как это сделал Фарадей, электролизом водных ацетатов. Они приняли продукт этих реакций за метильный радикал ( СН 3 ), димером которого является этан ( С 2 Н 6 ) .
Эту ошибку исправил в 1864 году Карл Шорлеммер , показавший, что продуктом всех этих реакций на самом деле является этан. [8] Этан был обнаружен растворенным в легкой сырой нефти Пенсильвании Эдмундом Рональдсом в 1864 году. [9] [10]
При стандартных температуре и давлении этан представляет собой бесцветный газ без запаха. Он имеет температуру кипения -88,5 ° C (-127,3 ° F) и температуру плавления -182,8 ° C (-297,0 ° F). Твердый этан существует в нескольких модификациях. [11] При охлаждении при нормальном давлении первой появляется модификация — пластичный кристалл , кристаллизующийся в кубической системе. В этой форме положения атомов водорода не фиксированы; молекулы могут свободно вращаться вокруг длинной оси. Охлаждение этого этана ниже ок. 89,9 К (-183,2 ° C; -297,8 ° F) превращает его в моноклинный метастабильный этан II ( пространственная группа P 21/n). [12] Этан очень мало растворим в воде.
Параметры связи этана были измерены с высокой точностью методами микроволновой спектроскопии и дифракции электронов: r C-C = 1,528(3) Å, r C-H = 1,088(5) Å и ∠CCH = 111,6(5)° с помощью микроволновое излучение и r C-C = 1,524(3) Å, r C-H = 1,089(5) Å и ∠CCH = 111,9(5)° по данным электронной дифракции (цифры в скобках представляют собой неопределенности в последних цифрах). [13]

Этан встречается в виде газовых примесей в атмосфере Земли , его концентрация на уровне моря в настоящее время составляет 0,5 частей на миллиард . [14] Глобальные объемы этана менялись с течением времени, вероятно, из-за сжигания на факелах месторождений природного газа . [15] Глобальные темпы выбросов этана снизились с 1984 по 2010 год, [15] хотя увеличение добычи сланцевого газа на формации Баккен в США остановило снижение вдвое. [16] [17]
Хотя этан является парниковым газом , его гораздо меньше, чем метана, его срок жизни составляет всего несколько месяцев, а не более десяти лет [18] , а также он менее эффективно поглощает радиацию по сравнению с массой. Фактически, потенциал глобального потепления этана во многом обусловлен его преобразованием в атмосфере в метан. [19] Он был обнаружен в качестве следового компонента в атмосферах всех четырех планет-гигантов , а также в атмосфере спутника Сатурна Титана . [20]
Атмосферный этан возникает в результате фотохимического воздействия Солнца на газообразный метан, который также присутствует в этих атмосферах: ультрафиолетовые фотоны с длиной волны короче 160 нм могут фотодиссоциировать молекулу метана на метильный радикал и атом водорода . При рекомбинации двух метильных радикалов образуется этан:
В атмосфере Земли гидроксильные радикалы преобразуют этан в пары метанола с периодом полураспада около трех месяцев. [18]
Предполагается, что этан, произведенный таким образом на Титане, попадает обратно на поверхность Луны и со временем накапливается в углеводородных морях, покрывающих большую часть полярных регионов Луны. В декабре 2007 года зонд Кассини обнаружил по крайней мере одно озеро на южном полюсе Титана, которое теперь называется Лакус Онтарио , поскольку его площадь аналогична озеру Онтарио на Земле (около 20 000 км 2 ). Дальнейший анализ данных инфракрасной спектроскопии, представленный в июле 2008 г. [21], предоставил дополнительные доказательства присутствия жидкого этана в Лакусе Онтарио. Несколько значительно более крупных углеводородных озер, два из которых являются Лигейя-Маре и Кракен-Маре , были обнаружены возле северного полюса Титана с помощью радиолокационных данных, собранных Кассини. Считается, что эти озера заполнены в основном смесью жидкого этана и метана.
В 1996 году этан был обнаружен в комете Хьякутаке [22] и с тех пор он был обнаружен в некоторых других кометах . Существование этана в этих далеких телах Солнечной системы может указывать на то, что этан был первичным компонентом солнечной туманности , из которой, как полагают, образовались Солнце и планеты.
В 2006 году Дейл Крукшанк из НАСА/Исследовательского центра Эймса ( соучастник исследования «Новые горизонты ») и его коллеги объявили о спектроскопическом открытии этана на поверхности Плутона . [23]
Этан можно рассматривать как две соединенные метильные группы , то есть димер метильных групп. В лаборатории этан можно удобно синтезировать электролизом Кольбе . В этом методе водный раствор ацетатной соли подвергается электролизу . На аноде ацетат окисляется с образованием углекислого газа и метальных радикалов, а высокореакционноспособные метильные радикалы объединяются с образованием этана:
Синтез окислением уксусного ангидрида пероксидами концептуально аналогичен.
В химии этана участвуют главным образом свободнорадикальные реакции . Этан может реагировать с галогенами , особенно с хлором и бромом , путем свободнорадикального галогенирования . Эта реакция протекает за счет распространения этильного радикала :
Поскольку галогенированные этаны могут подвергаться дальнейшему свободнорадикальному галогенированию, в результате этого процесса образуется смесь нескольких галогенированных продуктов. В химической промышленности для получения того или иного двухуглеродного галогеналкана используются более селективные химические реакции.
При полном сгорании этана выделяется 1559,7 кДж/моль или 51,9 кДж/г тепла и образуется углекислый газ и вода в соответствии с химическим уравнением :
Горение может происходить и без избытка кислорода, образуя смесь аморфного углерода и окиси углерода .
Горение происходит в результате сложной серии свободнорадикальных реакций. Компьютерное моделирование химической кинетики горения этана включало сотни реакций. Важным рядом реакций при горении этана является соединение этильного радикала с кислородом и последующий распад образующегося пероксида на этокси- и гидроксильные радикалы.
Основными углеродсодержащими продуктами неполного сгорания этана являются одноуглеродные соединения, такие как окись углерода и формальдегид . Одним из важных путей разрыва связи углерод-углерод в этане с образованием этих одноуглеродных продуктов является разложение этокси- радикала на метильный радикал и формальдегид , который, в свою очередь, может подвергаться дальнейшему окислению.
Некоторые второстепенные продукты неполного сгорания этана включают ацетальдегид , метан , метанол и этанол . При более высоких температурах, особенно в диапазоне 600–900 ° C (1112–1652 ° F), этилен является важным продуктом. Оно возникает в результате таких реакций:
Подобные реакции (с агентами, отличными от кислорода, в качестве абсорбера водорода) происходят при производстве этилена из этана при паровом крекинге .
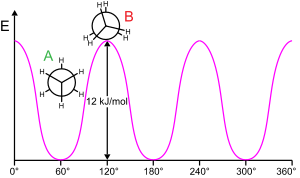
Вращение молекулярной субструктуры вокруг скручиваемой связи обычно требует энергии. Минимальная энергия, необходимая для вращения связи на 360°, называется вращательным барьером .
Этан дает классический и простой пример такого вращательного барьера, иногда называемого «этанным барьером». Среди самых ранних экспериментальных подтверждений существования этого барьера (см. диаграмму слева) было получено моделирование энтропии этана. [25] Три атома водорода на каждом конце могут свободно вращаться вокруг центральной связи углерод-углерод, если им предоставлена достаточная энергия для преодоления барьера. Физическое происхождение барьера до сих пор полностью не установлено [26] , хотя перекрывающееся (обменное) отталкивание [27] между атомами водорода на противоположных концах молекулы, пожалуй, является наиболее сильным кандидатом со стабилизирующим эффектом гиперсопряжения на смещенных конформация, способствующая этому явлению. [28] Теоретические методы, которые используют подходящую отправную точку (ортогональные орбитали), показывают, что гиперконъюгация является наиболее важным фактором в возникновении барьера вращения этана. [29] [30]
Еще в 1890–1891 годах химики предположили, что молекулы этана предпочитают шахматную конформацию, при которой два конца молекулы отклоняются друг от друга. [31] [32] [33] [34]
После метана этан является вторым по величине компонентом природного газа . Содержание этана в природном газе различных месторождений варьируется от менее 1% до более 6% по объему. До 1960-х годов этан и более крупные молекулы обычно не отделялись от метанового компонента природного газа, а просто сжигались вместе с метаном в качестве топлива. Сегодня этан является важным нефтехимическим сырьем и отделяется от других компонентов природного газа на большинстве хорошо разрабатываемых газовых месторождений. Этан также можно отделить от нефтяного газа — смеси газообразных углеводородов, получаемой как побочный продукт переработки нефти .
Этан наиболее эффективно отделяется от метана путем его сжижения при криогенных температурах. Существуют различные стратегии охлаждения: наиболее экономичный процесс, широко используемый в настоящее время, использует турбодетандер и позволяет восстановить более 90% этана в природном газе. В этом процессе охлажденный газ расширяется через турбину , снижая температуру примерно до -100 ° C (-148 ° F). При такой низкой температуре газообразный метан можно отделить от сжиженного этана и более тяжелых углеводородов путем перегонки . Дальнейшая перегонка отделяет этан от пропана и более тяжелых углеводородов.
Основное применение этана — производство этилена (этена) путем парового крекинга . При разбавлении паром и кратковременном нагревании до очень высоких температур (900 °С и более) тяжелые углеводороды распадаются на более легкие углеводороды, а насыщенные углеводороды становятся ненасыщенными . Этан предпочтителен для производства этилена, поскольку паровой крекинг этана достаточно селективен по отношению к этилену, в то время как паровой крекинг более тяжелых углеводородов дает смесь продуктов, бедную этиленом и более богатую более тяжелыми алкенами (олефинами) , такими как пропен (пропилен) и бутадиен . и в ароматических углеводородах .
Экспериментально этан исследуется как сырье для других химических веществ. Окислительное хлорирование этана уже давно считается потенциально более экономичным способом получения винилхлорида , чем хлорирование этилена. Многие процессы проведения этой реакции были запатентованы , но плохая селективность по отношению к винилхлориду и агрессивные условия реакции (в частности, реакционная смесь, содержащая соляную кислоту при температуре выше 500 ° C), препятствовали коммерциализации большинства из них. В настоящее время INEOS управляет пилотным заводом по производству винилхлорида из этана мощностью 1000 т / год в Вильгельмсхафене в Германии .
Аналогичным образом, саудовская фирма SABIC объявила о строительстве завода производительностью 30 000 т/год по производству уксусной кислоты путем окисления этана в Янбу . Экономическая жизнеспособность этого процесса может зависеть от низкой стоимости этана вблизи нефтяных месторождений Саудовской Аравии, и он может не конкурировать с карбонилированием метанола в других странах мира.
Этан может использоваться в качестве хладагента в криогенных холодильных системах. В гораздо меньших масштабах в научных исследованиях жидкий этан используется для остекловывания богатых водой образцов для криоэлектронной микроскопии . Тонкая пленка воды, быстро погруженная в жидкий этан при температуре -150 ° C или ниже, замерзает слишком быстро, чтобы вода могла кристаллизоваться. Более медленные методы замораживания могут привести к образованию кубических кристаллов льда, которые могут разрушить мягкие структуры , повредив образцы, и снизить качество изображения из-за рассеяния электронного луча до того, как он достигнет детектора.
MAN Energy Solutions в настоящее время производит двухтактные двухтопливные двигатели (B&W ME-GIE), которые могут работать как на морском дизельном топливе , так и на этане.
При комнатной температуре этан является чрезвычайно легковоспламеняющимся газом. При смешивании с воздухом в концентрации 3,0–12,5 % по объему образует взрывоопасную смесь.
Некоторые дополнительные меры предосторожности необходимы при хранении этана в виде криогенной жидкости. Прямой контакт с жидким этаном может привести к серьезному обморожению . Пока они не нагреются до комнатной температуры, пары жидкого этана тяжелее воздуха и могут стекать по полу или земле, собираясь в низких местах; если пары сталкиваются с источником возгорания, химическая реакция может вернуться к источнику этана, из которого они испарились.
Этан может вытеснять кислород и представлять опасность удушья . Этан не представляет известного острого или хронического токсикологического риска. Это не канцероген . [35]
Насыщенные неразветвленные ациклические углеводороды C 2 H 6 , C 3 H 8 и C 4 H 10 имеют сохраненные названия этан, пропан и бутан соответственно.