Белковый дизайн — это рациональный дизайн новых белковых молекул для разработки новой активности, поведения или цели, а также для улучшения базового понимания функции белка. [1] Белки могут быть разработаны с нуля ( дизайн de novo ) или путем создания рассчитанных вариантов известной структуры белка и его последовательности (называемый редизайном белка ). Рациональные подходы к белковому дизайну делают прогнозы белковой последовательности, которые будут складываться в определенные структуры. Эти предсказанные последовательности затем могут быть подтверждены экспериментально с помощью таких методов, как синтез пептидов , направленный мутагенез или искусственный синтез генов .
Рациональный дизайн белков берет свое начало в середине 1970-х годов. [2] Однако в последнее время появились многочисленные примеры успешного рационального дизайна водорастворимых и даже трансмембранных пептидов и белков, отчасти благодаря лучшему пониманию различных факторов, способствующих стабильности структуры белка , и разработке более совершенных вычислительных методов.
Цель рационального проектирования белков — предсказать аминокислотные последовательности , которые будут складываться в определенную структуру белка. Хотя число возможных последовательностей белков огромно и растет экспоненциально с размером белковой цепи, только подмножество из них будет надежно и быстро складываться в одно нативное состояние . Проектирование белков включает в себя идентификацию новых последовательностей в этом подмножестве. Нативное состояние белка — это конформационный минимум свободной энергии для цепи. Таким образом, проектирование белков — это поиск последовательностей, которые имеют выбранную структуру в качестве минимума свободной энергии. В некотором смысле, это обратная сторона предсказания структуры белка . При проектировании указывается третичная структура и идентифицируется последовательность, которая будет складываться в нее. Следовательно, это также называется обратным складыванием . Проектирование белков затем становится задачей оптимизации: с использованием некоторых критериев оценки выбирается оптимизированная последовательность, которая будет складываться в желаемую структуру.
Когда первые белки были рационально спроектированы в 1970-х и 1980-х годах, последовательность для них оптимизировалась вручную на основе анализов других известных белков, состава последовательности, зарядов аминокислот и геометрии желаемой структуры. [2] Первые спроектированные белки приписываются Бернду Гутте, который разработал уменьшенную версию известного катализатора, бычьей рибонуклеазы и третичных структур, состоящих из бета-слоев и альфа-спиралей, включая связующее вещество ДДТ . Урри и его коллеги позже разработали эластиноподобные фибриллярные пептиды на основе правил состава последовательности. Ричардсон и его коллеги разработали белок из 79 остатков без гомологии последовательности с известным белком. [2] В 1990 - х годах появление мощных компьютеров, библиотек конформаций аминокислот и силовых полей, разработанных в основном для моделирования молекулярной динамики, позволило разработать вычислительные инструменты проектирования белков на основе структуры. После разработки этих вычислительных инструментов за последние 30 лет был достигнут большой успех в проектировании белков. Первый белок, успешно разработанный полностью de novo, был создан Стивеном Майо и его коллегами в 1997 году [3] , а вскоре после этого, в 1999 году, Питер С. Ким и его коллеги разработали димеры, тримеры и тетрамеры неестественных правозакрученных спиралей . [4] [5] В 2003 году лаборатория Дэвида Бейкера разработала полный белок с укладкой, никогда ранее не встречавшейся в природе. [6] Позже, в 2008 году, группа Бейкера с помощью вычислений разработала ферменты для двух различных реакций. [7] В 2010 году одно из самых мощных широко нейтрализующих антител было выделено из сыворотки пациента с помощью разработанного с помощью вычислений белкового зонда. [8] Благодаря этим и другим успехам (например, см. примеры ниже), проектирование белков стало одним из важнейших инструментов, доступных для белковой инженерии . Есть большая надежда, что разработка новых белков, малых и больших, найдет применение в биомедицине и биоинженерии .
Программы проектирования белков используют компьютерные модели молекулярных сил, которые управляют белками в условиях in vivo . Чтобы сделать проблему разрешимой, эти силы упрощаются с помощью моделей проектирования белков. Хотя программы проектирования белков сильно различаются, они должны решать четыре основных вопроса моделирования: какова целевая структура дизайна, какая гибкость допускается для целевой структуры, какие последовательности включены в поиск и какое силовое поле будет использоваться для оценки последовательностей и структур.
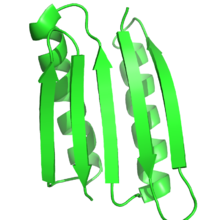
Функция белка сильно зависит от структуры белка, и рациональный дизайн белка использует эту связь для проектирования функции путем проектирования белков, которые имеют целевую структуру или складку. Таким образом, по определению, в рациональном дизайне белка целевая структура или ансамбль структур должны быть известны заранее. Это контрастирует с другими формами белковой инженерии, такими как направленная эволюция , где используются различные методы для поиска белков, которые достигают определенной функции, и с предсказанием структуры белка , где последовательность известна, но структура неизвестна.
Чаще всего целевая структура основана на известной структуре другого белка. Однако новые складки, не встречающиеся в природе, становятся все более возможными. Питер С. Ким и его коллеги разработали тримеры и тетрамеры неестественных спиральных спиралей, которые ранее не встречались в природе. [4] [5] Белок Top7, разработанный в лаборатории Дэвида Бейкера , был разработан полностью с использованием алгоритмов проектирования белков, с совершенно новой укладкой. [6] Совсем недавно Бейкер и его коллеги разработали ряд принципов для проектирования идеальных структур глобулярного белка на основе воронок сворачивания белка , которые связывают прогнозирование вторичной структуры и третичные структуры. Эти принципы, которые основываются как на прогнозировании структуры белка, так и на проектировании белка, были использованы для проектирования пяти различных новых топологий белка. [9]
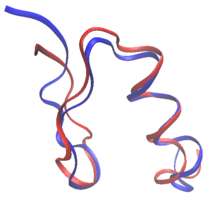
При рациональном проектировании белков белки могут быть перепроектированы из последовательности и структуры известного белка или полностью с нуля при проектировании белков de novo . При перепроектировании белков большинство остатков в последовательности сохраняются в виде аминокислот дикого типа, а некоторым разрешено мутировать. При проектировании de novo вся последовательность проектируется заново, не основываясь ни на какой предыдущей последовательности.
Как de novo дизайны, так и перепроектирование белков могут устанавливать правила для пространства последовательностей : конкретные аминокислоты, которые разрешены в каждой изменчивой позиции остатка. Например, состав поверхности зонда RSC3 для выбора ВИЧ-нейтрализующих антител был ограничен на основе эволюционных данных и балансировки заряда. Многие из самых ранних попыток проектирования белков в значительной степени основывались на эмпирических правилах для пространства последовательностей. [2] Более того, проектирование фибриллярных белков обычно следует строгим правилам для пространства последовательностей. Например, разработанные на основе коллагена белки часто состоят из повторяющихся паттернов Gly-Pro-X. [2] Появление вычислительных методов позволяет проектировать белки без вмешательства человека в выбор последовательности. [3]

В белковом дизайне целевая структура (или структуры) белка известны. Однако рациональный подход к белковому дизайну должен моделировать некоторую гибкость целевой структуры, чтобы увеличить количество последовательностей, которые могут быть разработаны для этой структуры, и минимизировать вероятность сворачивания последовательности в другую структуру. Например, при перепроектировании белка одной небольшой аминокислоты (такой как аланин) в плотно упакованном ядре белка, очень немногие мутанты будут предсказаны рациональным подходом к дизайну для сворачивания в целевую структуру, если окружающие боковые цепи не могут быть переупакованы.
Таким образом, существенным параметром любого процесса проектирования является количество гибкости, разрешенное как для боковых цепей, так и для основной цепи. В простейших моделях основная цепь белка остается жесткой, в то время как некоторым боковым цепям белка разрешено менять конформации. Однако боковые цепи могут иметь много степеней свободы в своих длинах связей, углах связей и двугранных углах χ . Чтобы упростить это пространство, методы проектирования белков используют библиотеки ротамеров, которые предполагают идеальные значения для длин связей и углов связей, ограничивая двугранные углы χ несколькими часто наблюдаемыми низкоэнергетическими конформациями, называемыми ротамерами .
Библиотеки ротамеров получены из статистического анализа многих структур белков. Библиотеки ротамеров, независимые от остова, описывают все ротамеры. [10] Библиотеки ротамеров , зависящие от остова, напротив, описывают ротамеры как вероятность их появления в зависимости от расположения остова белка вокруг боковой цепи. [11] Большинство программ проектирования белков используют одну конформацию (например, модальное значение для двугранных углов ротамера в пространстве) или несколько точек в области, описываемой ротамером; программа проектирования белков OSPREY, напротив, моделирует всю непрерывную область. [12]
Хотя рациональный дизайн белка должен сохранять общую складку остова белка, допущение некоторой гибкости остова может значительно увеличить количество последовательностей, которые сворачиваются в структуру, сохраняя при этом общую складку белка. [13] Гибкость остова особенно важна при перепроектировании белка, поскольку мутации последовательностей часто приводят к небольшим изменениям в структуре остова. Более того, гибкость остова может быть существенной для более продвинутых приложений дизайна белка, таких как прогнозирование связывания и дизайн ферментов. Некоторые модели гибкости остова дизайна белка включают небольшие и непрерывные глобальные движения остова, дискретные образцы остова вокруг целевой складки, движения трения и гибкость петли белка. [13] [14]

Рациональные методы проектирования белков должны быть способны различать последовательности, которые будут стабильны под целевой укладкой, от тех, которые предпочли бы другие низкоэнергетические конкурирующие состояния. Таким образом, проектирование белков требует точных энергетических функций , которые могут ранжировать и оценивать последовательности по тому, насколько хорошо они сворачиваются в целевую структуру. В то же время, однако, эти энергетические функции должны учитывать вычислительные проблемы, лежащие в основе проектирования белков. Одним из самых сложных требований для успешного проектирования является энергетическая функция, которая является как точной, так и простой для вычислительных расчетов.
Наиболее точные энергетические функции основаны на квантово-механических симуляциях. Однако такие симуляции слишком медленные и обычно непрактичные для проектирования белков. Вместо этого многие алгоритмы проектирования белков используют либо основанные на физике энергетические функции, адаптированные из программ моделирования молекулярной механики , либо основанные на знаниях энергетические функции , либо гибридную смесь того и другого. Тенденция была направлена на использование большего количества основанных на физике функций потенциальной энергии. [15]
Физические энергетические функции, такие как AMBER и CHARMM , обычно выводятся из квантово-механического моделирования и экспериментальных данных термодинамики, кристаллографии и спектроскопии. [16] Эти энергетические функции обычно упрощают физическую энергетическую функцию и делают их попарно разлагаемыми, что означает, что полная энергия конформации белка может быть рассчитана путем сложения попарной энергии между каждой парой атомов, что делает их привлекательными для алгоритмов оптимизации. Физические энергетические функции обычно моделируют притягивающе-отталкивающий член Леннарда-Джонса между атомами и попарный электростатический кулоновский член [17] между несвязанными атомами.

Статистические потенциалы, в отличие от потенциалов, основанных на физике, имеют преимущество в том, что их можно быстро вычислить, они неявно учитывают сложные эффекты и менее чувствительны к небольшим изменениям в структуре белка. [19] Эти энергетические функции основаны на выводе значений энергии из частоты появления в структурной базе данных.
Однако дизайн белка имеет требования, которые иногда могут быть ограничены в силовых полях молекулярной механики. Силовые поля молекулярной механики, которые в основном использовались в моделировании молекулярной динамики, оптимизированы для моделирования отдельных последовательностей, но дизайн белка ищет во многих конформациях многих последовательностей. Таким образом, силовые поля молекулярной механики должны быть адаптированы для дизайна белка. На практике энергетические функции дизайна белка часто включают как статистические термины, так и основанные на физике термины. Например, функция энергии Rosetta, одна из наиболее используемых энергетических функций, включает основанные на физике энергетические термины, происходящие из энергетической функции CHARMM, и статистические энергетические термины, такие как вероятность ротамера и электростатика, основанная на знаниях. Как правило, энергетические функции сильно настраиваются между лабораториями и специально подбираются для каждого дизайна. [16]
Вода составляет большую часть молекул, окружающих белки, и является основным двигателем структуры белка. Таким образом, моделирование взаимодействия между водой и белком имеет жизненно важное значение в проектировании белка. Количество молекул воды, которые взаимодействуют с белком в любой момент времени, огромно, и каждая из них имеет большое количество степеней свободы и партнеров по взаимодействию. Вместо этого программы проектирования белка моделируют большинство таких молекул воды как континуум, моделируя как гидрофобный эффект, так и поляризацию сольватации. [16]
Отдельные молекулы воды иногда могут играть решающую структурную роль в ядре белков и во взаимодействиях белок-белок или белок-лиганд. Неспособность смоделировать такие воды может привести к неверным прогнозам оптимальной последовательности интерфейса белок-белок. В качестве альтернативы молекулы воды могут быть добавлены к ротамерам. [16]
Целью проектирования белков является поиск последовательности белка, которая будет складываться в целевую структуру. Таким образом, алгоритм проектирования белков должен искать все конформации каждой последовательности относительно целевой складки и ранжировать последовательности в соответствии с конформацией с наименьшей энергией каждой из них, как определено энергетической функцией проектирования белков. Таким образом, типичным входом для алгоритма проектирования белков является целевая складка, пространство последовательностей, структурная гибкость и энергетическая функция, в то время как выходом является одна или несколько последовательностей, которые, как прогнозируется, будут стабильно складываться в целевую структуру.
Однако число потенциальных белковых последовательностей растет экспоненциально с числом белковых остатков; например, существует 20 100 белковых последовательностей длиной 100. Более того, даже если конформации боковой цепи аминокислот ограничены несколькими ротамерами (см. Структурная гибкость), это приводит к экспоненциальному числу конформаций для каждой последовательности. Таким образом, в нашем белке из 100 остатков и при условии, что каждая аминокислота имеет ровно 10 ротамеров, алгоритм поиска, который ищет в этом пространстве, должен будет искать более 200 100 белковых конформаций.
Наиболее распространенные функции энергии можно разложить на парные члены между ротамерами и типами аминокислот, что делает задачу комбинаторной, и для ее решения можно использовать мощные алгоритмы оптимизации. В этих случаях полная энергия каждой конформации, принадлежащей каждой последовательности, может быть сформулирована как сумма индивидуальных и парных членов между позициями остатков. Если проектировщик заинтересован только в лучшей последовательности, алгоритм проектирования белка требует только конформацию с самой низкой энергией последовательности с самой низкой энергией. В этих случаях аминокислотную идентичность каждого ротамера можно игнорировать, и все ротамеры, принадлежащие разным аминокислотам, можно рассматривать одинаково. Пусть r i будет ротамером в позиции остатка i в белковой цепи, а E( r i ) — потенциальной энергией между внутренними атомами ротамера. Пусть E ( r i , r j ) — потенциальной энергией между r i и ротамером r j в позиции остатка j . Затем мы определяем задачу оптимизации как задачу нахождения конформации с минимальной энергией ( E T ):
Задача минимизации E T является NP-трудной задачей. [14] [20] [21] Несмотря на то, что класс задач является NP-трудным, на практике многие примеры проектирования белков могут быть решены точно или удовлетворительно оптимизированы с помощью эвристических методов.
Несколько алгоритмов были разработаны специально для проблемы проектирования белков. Эти алгоритмы можно разделить на два больших класса: точные алгоритмы, такие как исключение тупиков , которые не гарантируют время выполнения , но гарантируют качество решения; и эвристические алгоритмы, такие как Монте-Карло, которые быстрее точных алгоритмов, но не гарантируют оптимальность результатов. Точные алгоритмы гарантируют, что процесс оптимизации выдал оптимум в соответствии с моделью проектирования белков. Таким образом, если предсказания точных алгоритмов терпят неудачу, когда они экспериментально подтверждены, то источник ошибки можно отнести к энергетической функции, допустимой гибкости, пространству последовательностей или целевой структуре (например, если она не может быть разработана для). [22]
Некоторые алгоритмы проектирования белков перечислены ниже. Хотя эти алгоритмы решают только самую базовую формулировку проблемы проектирования белков, Уравнение ( 1 ), когда цель оптимизации изменяется из-за того, что проектировщики вносят улучшения и расширения в модель проектирования белков, такие как улучшения допустимой структурной гибкости (например, гибкость остова белка) или включение сложных энергетических терминов, многие расширения проектирования белков, которые улучшают моделирование, построены поверх этих алгоритмов. Например, Rosetta Design включает сложные энергетические термины и гибкость остова, используя Монте-Карло в качестве базового алгоритма оптимизации. Алгоритмы OSPREY построены на алгоритме устранения тупиков и A* для включения непрерывных движений остова и боковой цепи. Таким образом, эти алгоритмы дают хорошее представление о различных типах алгоритмов, доступных для проектирования белков.
В 2020 году ученые сообщили о разработке процесса на основе ИИ с использованием геномных баз данных для проектирования новых белков на основе эволюции . Они использовали глубокое обучение для определения правил проектирования. [23] [24] В 2022 году исследование сообщило о программном обеспечении для глубокого обучения, которое может проектировать белки, содержащие заранее заданные функциональные сайты. [25] [26]
Алгоритм устранения тупика (DEE) итеративно уменьшает пространство поиска проблемы, удаляя ротамеры, которые, как можно доказать, не являются частью глобальной конформации с самой низкой энергией (GMEC). На каждой итерации алгоритм устранения тупика сравнивает все возможные пары ротамеров в каждой позиции остатка и удаляет каждый ротамер r′ i , который, как можно показать, всегда имеет более высокую энергию, чем другой ротамер r i, и, таким образом, не является частью GMEC:
Другие мощные расширения алгоритма устранения тупиков включают критерий устранения пар и обобщенный критерий устранения тупиков . Этот алгоритм также был расширен для обработки непрерывных ротамеров с доказуемыми гарантиями.
Хотя алгоритм устранения тупика работает за полиномиальное время на каждой итерации, он не может гарантировать сходимость. Если после определенного количества итераций алгоритм устранения тупика не отсекает больше ротамеров, то либо ротамеры должны быть объединены, либо должен быть использован другой алгоритм поиска для поиска в оставшемся пространстве поиска. В таких случаях устранение тупика действует как алгоритм предварительной фильтрации для сокращения пространства поиска, в то время как другие алгоритмы, такие как A*, Монте-Карло, линейное программирование или FASTER, используются для поиска в оставшемся пространстве поиска. [14]
Конформационное пространство конструкции белка можно представить в виде дерева , где остатки белка упорядочены произвольным образом, а ветви дерева находятся на каждом из ротамеров в остатке. Алгоритмы ветвей и границ используют это представление для эффективного исследования дерева конформации: на каждом ветвлении алгоритмы ветвей и границ ограничивают пространство конформации и исследуют только перспективные ветви. [14] [27] [28]
Популярным алгоритмом поиска для проектирования белков является алгоритм поиска A* . [14] [28] A* вычисляет нижнюю оценку для каждого частичного пути дерева, которая ограничивает (с гарантиями) энергию каждого из расширенных ротамеров. Каждая частичная конформация добавляется в очередь приоритетов, и на каждой итерации частичный путь с самой низкой нижней границей извлекается из очереди и расширяется. Алгоритм останавливается, как только будет перечислена полная конформация, и гарантирует, что конформация является оптимальной.
Оценка A* f в белковом дизайне состоит из двух частей, f=g+h . g — точная энергия ротамеров, которые уже были назначены в частичной конформации. h — нижняя граница энергии ротамеров, которые еще не были назначены. Каждая из них спроектирована следующим образом, где d — индекс последнего назначенного остатка в частичной конформации.
Проблему оптимизации E T (уравнение ( 1 )) можно легко сформулировать как целочисленное линейное программирование (ILP). [29] Одна из самых мощных формулировок использует двоичные переменные для представления наличия ротамера и ребер в конечном решении и ограничивает решение наличием ровно одного ротамера для каждого остатка и одного попарного взаимодействия для каждой пары остатков:
ул
Решатели ILP, такие как CPLEX , могут вычислять точное оптимальное решение для больших примеров задач проектирования белков. Эти решатели используют линейное программирование релаксации задачи, где q i и q ij могут принимать непрерывные значения, в сочетании с алгоритмом ветвления и разрезания для поиска только небольшой части пространства конформации для оптимального решения. Было показано, что решатели ILP решают множество примеров проблемы размещения боковой цепи. [29]
Решатели ILP зависят от алгоритмов линейного программирования (LP), таких как симплексные или барьерные методы для выполнения релаксации LP на каждой ветви. Эти алгоритмы LP были разработаны как методы оптимизации общего назначения и не оптимизированы для задачи проектирования белка (уравнение ( 1 )). В результате релаксация LP становится узким местом решателей ILP, когда размер задачи большой. [30] Недавно было разработано несколько альтернатив, основанных на алгоритмах передачи сообщений, специально для оптимизации релаксации LP задачи проектирования белка. Эти алгоритмы могут аппроксимировать как двойственные, так и первичные экземпляры целочисленного программирования, но для сохранения гарантий оптимальности они наиболее полезны при использовании для аппроксимации двойственной задачи проектирования белка, поскольку аппроксимация двойственной гарантирует, что не будет пропущено ни одного решения. Приближения, основанные на передаче сообщений, включают алгоритм передачи сообщений с перевзвешенным максимальным произведением дерева [31] [32] и алгоритм линейного программирования с передачей сообщений [33] .
Монте-Карло — один из наиболее широко используемых алгоритмов для проектирования белков. В своей простейшей форме алгоритм Монте-Карло выбирает остаток случайным образом, и в этом остатке оценивается случайно выбранный ротамер (любой аминокислоты). [21] Новая энергия белка, E new , сравнивается со старой энергией E old , и новый ротамер принимается с вероятностью:
где β — постоянная Больцмана , а температура T может быть выбрана таким образом, чтобы в начальных раундах она была высокой и медленно отжигалась для преодоления локальных минимумов. [12]
Алгоритм FASTER использует комбинацию детерминированных и стохастических критериев для оптимизации аминокислотных последовательностей. Сначала FASTER использует DEE для устранения ротамеров, которые не являются частью оптимального решения. Затем серия итеративных шагов оптимизирует назначение ротамеров. [34] [35]
При распространении убеждений для проектирования белков алгоритм обменивается сообщениями, описывающими убеждение , которое каждый остаток имеет относительно вероятности каждого ротамера в соседних остатках. Алгоритм обновляет сообщения на каждой итерации и повторяет до сходимости или до фиксированного числа итераций. Сходимость не гарантируется при проектировании белков. Сообщение m i→ j (r j , которое остаток i отправляет каждому ротамеру (r j в соседнем остатке j , определяется как:
Для оптимизации конструкции белка использовались методы распространения убеждений как максимального произведения, так и суммы произведений.
Дизайн новых ферментов — это использование дизайна белков с огромными биоинженерными и биомедицинскими приложениями. В целом, дизайн структуры белка может отличаться от дизайна фермента, поскольку дизайн ферментов должен учитывать множество состояний, вовлеченных в каталитический механизм . Однако дизайн белка является предпосылкой дизайна ферментов de novo , поскольку, по крайней мере, дизайн катализаторов требует каркаса, в который может быть вставлен каталитический механизм. [36]
Большой прогресс в разработке и перепроектировании ферментов de novo был достигнут в первом десятилетии 21-го века. В трех крупных исследованиях Дэвид Бейкер и его коллеги de novo разработали ферменты для ретроальдольной реакции , [37] реакции элиминирования Кемпа, [38] и для реакции Дильса-Альдера . [39] Кроме того, Стивен Майо и его коллеги разработали итерационный метод для разработки наиболее эффективного известного фермента для реакции элиминирования Кемпа. [40] Кроме того, в лаборатории Брюса Дональда вычислительное проектирование белка использовалось для переключения специфичности одного из доменов белка нерибосомальной пептидсинтетазы , которая производит грамицидин S , с его естественного субстрата фенилаланина на другие неродственные субстраты, включая заряженные аминокислоты; перепроектированные ферменты имели активность, близкую к активности дикого типа. [41]
Полурациональный дизайн — это метод целенаправленной модификации, основанный на определенном понимании последовательности, структуры и каталитического механизма ферментов. Этот метод находится между иррациональным дизайном и рациональным дизайном. Он использует известную информацию и средства для выполнения эволюционной модификации определенных функций целевого фермента. Характерной чертой полурационального дизайна является то, что он не полагается исключительно на случайную мутацию и скрининг, а объединяет концепцию направленной эволюции. Он создает библиотеку случайных мутантов с различными последовательностями посредством мутагенеза , подверженного ошибкам RCR , рекомбинации ДНК и мутагенеза с насыщением сайтов . В то же время он использует понимание ферментов и принципов дизайна для целенаправленного отсеивания мутантов с желаемыми характеристиками.
Методология полурационального дизайна подчеркивает глубокое понимание ферментов и контроль эволюционного процесса. Она позволяет исследователям использовать известную информацию для управления эволюционным процессом, тем самым повышая эффективность и успешность. Этот метод играет важную роль в модификации функций белка, поскольку он может сочетать преимущества иррационального дизайна и рационального дизайна, а также может исследовать неизвестное пространство и использовать известные знания для целенаправленной модификации.
Полурациональный дизайн имеет широкий спектр применения, включая, но не ограничиваясь оптимизацией ферментов, модификацией лекарственных мишеней, эволюцией биокатализаторов и т. д. С помощью этого метода исследователи могут более эффективно улучшать функциональные свойства белков для удовлетворения конкретных биотехнологических или медицинских нужд. Хотя этот метод предъявляет высокие требования к информации и технологиям и относительно сложен в реализации, с развитием вычислительной техники и биоинформатики перспективы применения полурационального дизайна в белковой инженерии становятся все шире. [42]
Белково-белковые взаимодействия участвуют в большинстве биотических процессов. Многие из наиболее трудно поддающихся лечению заболеваний, такие как болезнь Альцгеймера , многие формы рака (например, TP53 ) и инфекция вируса иммунодефицита человека ( ВИЧ ), включают белок-белковые взаимодействия. Таким образом, для лечения таких заболеваний желательно разрабатывать белковые или белок-подобные терапевтические средства, которые связывают одного из партнеров взаимодействия и, таким образом, нарушают взаимодействие, вызывающее болезнь. Это требует разработки белково-терапевтических средств для сродства к своему партнеру.
Белково-белковые взаимодействия могут быть разработаны с использованием алгоритмов проектирования белков, поскольку принципы, которые управляют стабильностью белка, также управляют связыванием белок-белок. Однако проектирование белок-белкового взаимодействия представляет собой проблемы, которые обычно не присутствуют в проектировании белков. Одна из самых важных проблем заключается в том, что, как правило, интерфейсы между белками более полярны, чем ядра белков, и связывание подразумевает компромисс между десольватацией и образованием водородных связей. [43] Чтобы преодолеть эту проблему, Брюс Тайдор и его коллеги разработали метод улучшения сродства антител, сосредоточившись на электростатических вкладах. Они обнаружили, что для антител, разработанных в исследовании, снижение затрат на десольватацию остатков в интерфейсе увеличило сродство пары связывания. [43] [44] [45]
Функции энергии дизайна белка должны быть адаптированы для оценки прогнозов связывания, поскольку связывание подразумевает компромисс между конформациями свободных белков с наименьшей энергией ( EP и EL ) и конформацией связанного комплекса с наименьшей энергией ( EPL ):
Алгоритм K* аппроксимирует константу связывания алгоритма, включая конформационную энтропию в расчет свободной энергии. Алгоритм K* рассматривает только конформации с самой низкой энергией свободных и связанных комплексов (обозначаемые наборами P , L и PL ) для аппроксимации функций распределения каждого комплекса: [14]
Дизайн белок-белковых взаимодействий должен быть высокоспецифичным, поскольку белки могут взаимодействовать с большим количеством белков; успешный дизайн требует селективных связующих веществ. Таким образом, алгоритмы дизайна белков должны иметь возможность различать целевое (или положительное проектирование ) и нецелевое связывание (или отрицательное проектирование ). [2] [43] Одним из наиболее ярких примеров дизайна для специфичности является дизайн специфических bZIP -связывающих пептидов Эми Китинг и ее коллег для 19 из 20 семейств bZIP; 8 из этих пептидов были специфичны для своего предполагаемого партнера по сравнению с конкурирующими пептидами. [43] [46] [47] Кроме того, положительный и отрицательный дизайн также использовались Андерсоном и его коллегами для прогнозирования мутаций в активном центре мишени препарата, которые придавали резистентность к новому препарату; положительный дизайн использовался для поддержания активности дикого типа, в то время как отрицательный дизайн использовался для нарушения связывания препарата. [48] Недавняя компьютерная переделка Костаса Маранаса и его коллег также позволила экспериментально переключить специфичность кофактора ксилозоредуктазы Candida boidinii с НАДФН на НАДН . [49]
Реструктуризация белка заключается в проектировании поверхности белка с сохранением общей складки, ядра и граничных областей белка нетронутыми. Реструктуризация белка особенно полезна для изменения связывания белка с другими белками. Одним из наиболее важных применений реструктуризации белка была разработка зонда RSC3 для выбора широко нейтрализующих антител к ВИЧ в Центре исследований вакцин NIH. Сначала были выбраны остатки за пределами интерфейса связывания между оболочечным белком ВИЧ gp120 и ранее обнаруженным антителом b12 для проектирования. Затем был выбран интервал последовательностей на основе эволюционной информации, растворимости, сходства с диким типом и других соображений. Затем программное обеспечение RosettaDesign использовалось для поиска оптимальных последовательностей в выбранном пространстве последовательностей. Позднее RSC3 использовался для обнаружения широко нейтрализующего антитела VRC01 в сыворотке длительно инфицированного ВИЧ человека без прогрессирования. [50]
Глобулярные белки — это белки, которые содержат гидрофобное ядро и гидрофильную поверхность. Глобулярные белки часто принимают стабильную структуру, в отличие от фибриллярных белков , которые имеют множественные конформации. Трехмерную структуру глобулярных белков обычно легче определить с помощью рентгеновской кристаллографии и ядерного магнитного резонанса, чем как фибриллярные белки, так и мембранные белки , что делает глобулярные белки более привлекательными для проектирования белков, чем другие типы белков. Большинство успешных разработок белков включали глобулярные белки. И RSD-1, и Top7 были de novo разработками глобулярных белков. Еще пять структур белков были разработаны, синтезированы и проверены в 2012 году группой Бейкера. Эти новые белки не выполняют биотической функции, но структуры предназначены для того, чтобы действовать как строительные блоки, которые можно расширить для включения функциональных активных участков. Структуры были найдены вычислительным путем с использованием новой эвристики, основанной на анализе соединительных петель между частями последовательности, которые определяют вторичные структуры. [51]
Было успешно разработано несколько трансмембранных белков [52] , а также множество других мембранно-ассоциированных пептидов и белков. [53] Недавно Костас Маранас и его коллеги разработали автоматизированный инструмент [54] для изменения размера пор внешнего мембранного порина типа F (OmpF) E.coli до любого желаемого субнанометрового размера и собрали их в мембраны для выполнения точного разделения в ангстремном масштабе.
Одно из самых желательных применений дизайна белков — это биосенсоры , белки, которые будут определять присутствие определенных соединений. Некоторые попытки в дизайне биосенсоров включают сенсоры для неестественных молекул, включая TNT . [55] Совсем недавно Кульман и его коллеги разработали биосенсор PAK1 . [ 56]
В некотором смысле, проектирование белков является подмножеством проектирования батарей . [ необходимо дальнейшее объяснение ]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )