
Феноксигербициды (или « фенокси ») — это два семейства химикатов, которые были разработаны как коммерчески важные гербициды , широко используемые в сельском хозяйстве . Они разделяют часть структуры феноксиуксусной кислоты .
Первая обнаруженная группа действует, имитируя гормон роста ауксин, индолилуксусную кислоту (ИУК). [1] При распылении на широколиственные растения они вызывают быстрый, неконтролируемый рост («растут до смерти»). Таким образом, при применении к однодольным культурам, таким как пшеница или кукуруза , они выборочно убивают широколиственные сорняки, оставляя культуры относительно нетронутыми.
Представленные в 1946 году, эти гербициды широко использовались в сельском хозяйстве к середине 1950-х годов. Наиболее известными феноксигербицидами являются (4-хлор-2-метилфенокси)уксусная кислота ( MCPA ), 2,4-дихлорфеноксиуксусная кислота (2,4-D) и 2,4,5-трихлорфеноксиуксусная кислота (2,4,5-T). [2] Аналоги каждого из этих трех соединений с дополнительной метильной группой, присоединенной рядом с карбоксильной кислотой , впоследствии были коммерциализированы как мекопроп , дихлорпроп и фенопроп . Добавление метильной группы создает хиральный центр в этих молекулах, и биологическая активность обнаружена только в (2R)-изомере (показано для дихлорпропа). [3]
Другие члены этой группы включают 4-(2,4-дихлорфенокси)масляную кислоту ( 2,4-DB ) и 4-(4-хлор-2-метилфенокси)масляную кислоту ( MCPB ), которые действуют как пропестициды для 2,4-D и MCPA соответственно: то есть они преобразуются в растениях в эти активные ингредиенты. [4] Все ауксиновые гербициды сохраняют активность при применении в виде солей и эфиров , поскольку они также способны производить исходную кислоту in situ .

Использование гербицидов в сельском хозяйстве США картировано Геологической службой США. По состоянию на 2019 год [обновлять]2,4-Д был наиболее используемым из ауксинов. В тот год было распылено 45 000 000 фунтов (20 000 000 кг) [5] по сравнению с 2 000 000 фунтов (910 000 кг) следующего по интенсивности применения ауксина MCPA. [6] Другим ауксином, который сейчас используется в сопоставимых количествах с 2,4-Д, является дикамба , где показатель 2019 года составил 30 000 000 фунтов (14 000 000 кг). [7] Это бензойная кислота, а не феноксиуксусная кислота, использование которой быстро возросло с 2016 года, поскольку были выращены культуры, генетически модифицированные для устойчивости к ней. [8]
В 1970-х годах агрохимические компании работали над разработкой новых гербицидов, которые могли бы дополнять ауксины. Целью было найти материалы, которые бы избирательно контролировали злаковые сорняки в широколиственных культурах, таких как хлопок и соя .

В 1973 году Hoechst AG подала патенты на новый класс соединений, арилоксфеноксипропионаты, которые показали такую селективность и привели к коммерциализации диклофопа. Затем японская компания Ishihara Sangyo Kaisha (ISK) обнаружила улучшенную биологическую активность в аналоге, хлоразифопе, который заменил арилокси-часть диклофопа на пиридиновое кольцо, содержащее те же два заместителя хлора. Эта область исследований стала очень конкурентоспособной, и в течение трех недель друг за другом в 1977 году ISK, Dow Chemicals и Imperial Chemical Industries (ICI) подали патенты, охватывающие другую группу аналогов, с трифторметильной (CF 3 ) группой вместо одного из атомов хлора в пиридине. Впоследствии ISK и ICI перекрестно лицензировали свою интеллектуальную собственность и впервые выпустили на рынок флуазифоп в виде его бутилового эфира в 1981 году под торговой маркой Fusilade, в то время как Dow выпустила на рынок галоксифоп в виде его метилового эфира. [9] Все эти соединения имеют дополнительную кислородно-связанную ароматическую группу в пара-положении фенильного кольца с его группой OCH(CH 3 )COOH и как класс называются «fops», ссылаясь на их общую фенокси-фенокси [sic] особенность. [10]
Эта группа гербицидов действует путем ингибирования ацетил-КоА-карбоксилазы растений (АССазы), что является совершенно иным механизмом действия по сравнению с ауксинами. [11] [12] Их селективность по отношению к злакам возникает из-за того, что они нацелены на изоформу фермента , присутствующую только в пластидах этих видов , что делает их неэффективными по отношению к широколиственным сорнякам и другим организмам, включая млекопитающих. [13] При применении в виде эфира метаболизм в целевом растении приводит к образованию исходной кислоты, которая отвечает за гербицидное действие. [9] [14] Совпадением является то, что именно стереоизомер (2R) связывается с АССазой растений, так же как этот изомер отвечает за активность дихлорпропа как ауксина.
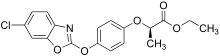

Соли и эфиры этого класса гербицидов активны благодаря своей способности метаболизироваться до соответствующей исходной кислоты. Например, феноксапроп-P этил [15] был представлен Bayer Crop Science , а квизалофоп-P этил — Nissan Chemical Corporation , оба в 1989 году. [16] В 1990 году Dow представила цигалофоп-P бутил для борьбы с сорняками на рисе. [17] Флуазифоп-P бутил [18] по-прежнему широко используется в США. В 2018 году было применено 200 000 фунтов (91 000 кг) — почти исключительно на соевых бобах. [19] «P» в названии этих материалов указывает на их использование в настоящее время в качестве отдельных энантиомеров .
Cummins et al. , 1999, 2009 и 2013 обнаружили, что механизм устойчивости Alopecurus myocuroides к феноксапропу-P-этилу снижает концентрацию перекиси водорода в месте применения, в то время как дикий тип реагирует увеличением. [20]