
Динеины — это семейство цитоскелетных моторных белков , которые перемещаются вдоль микротрубочек в клетках . Они преобразуют химическую энергию, запасенную в АТФ, в механическую работу . Динеин транспортирует различные клеточные грузы , обеспечивает силы и смещения, важные для митоза , и управляет биением ресничек и жгутиков эукариот . Все эти функции основаны на способности динеина перемещаться к минус-концу микротрубочек, что известно как ретроградный транспорт ; таким образом, их называют «моторами, направленными к минус-концу». Напротив, большинство моторных белков кинезина перемещаются к плюс-концу микротрубочек, что называется антероградным транспортом .
Динеины можно разделить на две группы: цитоплазматические динеины и аксонемальные динеины , которые также называют ресничными или жгутиковыми динеинами.
Аксонемальный динеин вызывает скольжение микротрубочек в аксонемах ресничек и жгутиков и обнаруживается только в клетках, имеющих такие структуры .
Цитоплазматический динеин, обнаруженный во всех клетках животных и, возможно, также в клетках растений, выполняет функции, необходимые для выживания клеток, такие как транспорт органелл и сборка центросом . [1] Цитоплазматический динеин движется поступательно вдоль микротрубочки; то есть, один или другой его стебель всегда прикреплен к микротрубочке, так что динеин может «пройти» значительное расстояние вдоль микротрубочки, не отсоединяясь.
Цитоплазматический динеин помогает позиционировать комплекс Гольджи и другие органеллы в клетке. [1] Он также помогает транспортировать груз, необходимый для функционирования клетки, такой как везикулы, созданные эндоплазматическим ретикулумом , эндосомы и лизосомы (Карп, 2005). Динеин участвует в перемещении хромосом и позиционировании митотических веретен для деления клеток. [2] [3] Динеин переносит органеллы, везикулы и, возможно , фрагменты микротрубочек вдоль аксонов нейронов к телу клетки в процессе, называемом ретроградным аксональным транспортом . [1] Кроме того, мотор динеина также отвечает за транспорт деградирующих эндосом ретроградно в дендритах. [4]
Цитоплазматический динеин позиционирует веретено в месте цитокинеза , прикрепляясь к клеточному кортексу и натягивая астральные микротрубочки, исходящие из центросомы . Будучи постдокторантом в Массачусетском технологическом институте, Томоми Киёмицу обнаружил, что динеин играет роль моторного белка в выравнивании хромосом в середине клетки во время метафазы митоза. Динеин тянет микротрубочки и хромосомы к одному концу клетки. Когда конец микротрубочек приближается к клеточной мембране, они высвобождают химический сигнал, который выталкивает динеин на другую сторону клетки. Он делает это неоднократно, поэтому хромосомы оказываются в центре клетки, что необходимо при митозе. [5] [6] [7] [8] Почкующиеся дрожжи были мощным модельным организмом для изучения этого процесса и показали, что динеин нацелен на плюс-концы астральных микротрубочек и доставляется в клеточный кортекс через механизм разгрузки. [9] [10]
Динеин и кинезин могут использоваться вирусами для опосредования процесса вирусной репликации. Многие вирусы используют систему транспорта микротрубочек для транспортировки ядер нуклеиновой кислоты/белка к внутриклеточным сайтам репликации после вторжения в клеточную мембрану. [11] О сайтах связывания вирусов, специфичных для моторов, известно немного, но известно, что некоторые вирусы содержат последовательности, богатые пролином (которые расходятся между вирусами), которые при удалении снижают связывание динактина , транспорт аксонов (в культуре) и нейроинвазию in vivo. [12] Это говорит о том, что последовательности, богатые пролином, могут быть основным сайтом связывания, который поглощает динеин.

Каждая молекула мотора динеина представляет собой сложную белковую сборку, состоящую из множества более мелких полипептидных субъединиц. Цитоплазматический и аксонемальный динеин содержат некоторые из тех же компонентов, но они также содержат некоторые уникальные субъединицы.
Цитоплазматический динеин, молекулярная масса которого составляет около 1,5 мегадальтон (МДа), представляет собой димер димеров, содержащий около двенадцати полипептидных субъединиц: две идентичные «тяжелые цепи» массой 520 кДа, которые содержат активность АТФазы и, таким образом, отвечают за создание движения вдоль микротрубочки; две промежуточные цепи массой 74 кДа, которые, как полагают, прикрепляют динеин к его грузу; две легкие промежуточные цепи массой 53–59 кДа; и несколько легких цепей.
Активность АТФазы, генерирующая силу, каждой тяжелой цепи динеина находится в ее большой «голове» в форме пончика, которая связана с другими белками AAA , в то время как два выступа от головки соединяют ее с другими цитоплазматическими структурами. Один выступ, спирально-спиральный стебель, связывается с поверхностью микротрубочки и «прогуливается» по ней посредством повторяющегося цикла отсоединения и повторного присоединения. Другой выступ, удлиненный хвост, связывается с легкими промежуточными, промежуточными и легкими субъединицами цепи, которые прикрепляют динеин к его грузу. Чередующаяся активность парных тяжелых цепей в полном цитоплазматическом моторе динеина позволяет одной молекуле динеина транспортировать свой груз, «проходя» значительное расстояние вдоль микротрубочки, не отсоединяясь полностью.
В апо-состоянии динеина мотор свободен от нуклеотидов, кольцо домена AAA существует в открытой конформации, [14] а MTBD существует в состоянии высокой аффинности. [15] Многое о доменах AAA остается неизвестным, [16] но AAA1 хорошо известен как основной участок гидролиза АТФ в динеине. [17] Когда АТФ связывается с AAA1, он инициирует конформационное изменение кольца домена AAA в «закрытую» конфигурацию, перемещение опоры, [14] и конформационное изменение в линкере. [18] [19] Линкер изгибается и смещается от AAA5 к AAA2, оставаясь связанным с AAA1. [14] [19] Одна прикрепленная альфа -спираль от стебля вытягивается опорой, сдвигая спираль на половину гептадного повтора относительно ее партнера по спиральной спирали, [15] [20] и изгибая стебель. [14] В результате MTBD динеина переходит в состояние с низким сродством, позволяя мотору перемещаться к новым сайтам связывания. [21] [22] После гидролиза АТФ стебель вращается, перемещая динеин дальше вдоль МТ. [18] После высвобождения фосфата MTBD возвращается в состояние с высоким сродством и повторно связывает МТ, запуская рабочий ход. [23] Линкер возвращается в прямую конформацию и поворачивается обратно к AAA5 от AAA2 [24] [25] и создает рычажное действие, [26] производя наибольшее смещение динеина, достигаемое рабочим ходом [18] Цикл завершается высвобождением АДФ, который возвращает кольцо домена AAA обратно в «открытую» конфигурацию. [22]
Дрожжевой динеин может перемещаться по микротрубочкам без отсоединения, однако у метазоа цитоплазматический динеин должен быть активирован связыванием динактина , другого многосубъединичного белка, необходимого для митоза , и адаптера груза. [27] Трикомплекс, включающий динеин, динактин и адаптер груза, является ультрапроцессивным и может перемещаться на большие расстояния без отсоединения, чтобы достичь внутриклеточного места назначения груза. Адаптеры груза, идентифицированные на данный момент, включают BicD2 , Hook3 , FIP3 и Spindly. [27] Легкая промежуточная цепь, которая является членом суперсемейства Ras , опосредует присоединение нескольких адаптеров груза к двигателю динеина. [28] Другие хвостовые субъединицы также могут способствовать этому взаимодействию, как показано в структуре низкого разрешения динеин-динактин-BicD2. [29]
Одной из основных форм регуляции моторики внутри клеток для динеина является динактин. Он может быть необходим почти для всех функций цитоплазматического динеина. [30] В настоящее время это наиболее изученный партнер динеина. Динактин — это белок, который помогает во внутриклеточном транспорте по всей клетке, связываясь с цитоплазматическим динеином. Динактин может функционировать как каркас для связывания других белков. Он также функционирует как фактор привлечения, который локализует динеин там, где ему следует быть. [31] [32] Также есть некоторые данные, предполагающие, что он может регулировать кинезин-2. [33] Комплекс динактина состоит из более чем 20 субъединиц, [29] из которых p150 (Glued) является самой большой. [34] Нет окончательных доказательств того, что динактин сам по себе влияет на скорость мотора. Однако он влияет на процессивность мотора. [35] Регуляция связывания, вероятно, аллостерическая: эксперименты показали, что улучшения, обеспечиваемые в процессивности мотора динеина, не зависят от домена связывания субъединицы p150 с микротрубочками. [36]
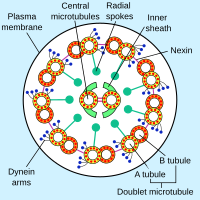
Аксонемальные динеины существуют в нескольких формах, которые содержат одну, две или три неидентичные тяжелые цепи (в зависимости от организма и расположения в ресничке ) . Каждая тяжелая цепь имеет глобулярный моторный домен со структурой в форме пончика, которая, как полагают, напоминает структуру других белков AAA , спиральный «стебель», который связывается с микротрубочкой, и удлиненный хвост (или «ствол»), который прикрепляется к соседней микротрубочке той же аксонемы . Таким образом, каждая молекула динеина образует поперечный мостик между двумя соседними микротрубочками цилиарной аксонемы. Во время «силового удара», который вызывает движение, моторный домен AAA-АТФазы претерпевает конформационное изменение, которое заставляет связывающий микротрубочки стебель поворачиваться относительно связывающего груз хвоста, в результате чего одна микротрубочка скользит относительно другой (Karp, 2005). Это скольжение создает изгибающее движение, необходимое ресничкам для удара и продвижения клетки или других частиц. Группы молекул динеина, ответственные за движение в противоположных направлениях, вероятно, активируются и дезактивируются скоординированно, так что реснички или жгутики могут двигаться вперед и назад. Радиальная спица была предложена как (или одна из) структур, которая синхронизирует это движение.
Регуляция активности аксонемального динеина имеет решающее значение для частоты биения жгутиков и формы волны ресничек. Режимы регуляции аксонемального динеина включают фосфорилирование, окислительно-восстановительный и кальциевый. Механические силы на аксонеме также влияют на функцию аксонемального динеина. Тяжелые цепи внутренних и внешних плеч аксонемального динеина фосфорилируются/дефосфорилируются для контроля скорости скольжения микротрубочек. Тиоредоксин, связанный с другими плечами аксонемального динеина, окисляется/восстанавливается для регулирования того, где динеин связывается в аксонеме. Центрин и компоненты внешних плеч аксонемального динеина обнаруживают колебания концентрации кальция. Колебания кальция играют важную роль в изменении формы волны ресничек и частоты биения жгутиков (King, 2012). [37]
Белок, отвечающий за движение ресничек и жгутиков, был впервые обнаружен и назван динеином в 1963 году (Карп, 2005). 20 лет спустя был выделен и идентифицирован цитоплазматический динеин, существование которого предполагалось с момента открытия жгутикового динеина (Карп, 2005).
Расхождение гомологичных хромосом на противоположные полюса клетки происходит во время первого деления мейоза . Правильное расхождение необходимо для получения гаплоидных мейотических продуктов с нормальным набором хромосом. Образование хиазм (события кроссоверной рекомбинации), по-видимому, в целом способствует правильному расхождению. Однако у делящихся дрожжей Schizosaccharomyces pombe при отсутствии хиазм динеин способствует расхождению. [38] Dhc1, моторная субъединица динеина, необходима для расхождения хромосом как при наличии, так и при отсутствии хиазм. [38] Белок легкой цепи динеина Dlc1 также необходим для расхождения, особенно при отсутствии хиазм.