Ингибиторы рецепторов аденозиндифосфата ( АДФ ) представляют собой класс лекарственных средств антиагрегантных агентов , используемых при лечении острого коронарного синдрома (ОКС) или в профилактическом лечении пациентов, которые подвержены риску тромбоэмболии , инфаркта миокарда или инсульта . Эти препараты являются антагонистами рецепторов тромбоцитов P2Y 12 и, следовательно, предотвращают связывание АДФ с рецептором P2Y 12. Это приводит к снижению агрегации тромбоцитов, препятствуя образованию тромбов. Рецептор P2Y 12 представляет собой поверхностно связанный белок , обнаруженный на тромбоцитах крови . Они относятся к пуринергическим рецепторам, связанным с G-белком (GPCR), и являются хеморецепторами для АДФ. [1]
Первым препаратом , представленным в этом классе, был тиклопидин , но из-за побочных эффектов он сегодня не так широко используется. Тиклопидин, клопидогрель и прасугрель (Эфиент) — все это тиенопиридины , которые вызывают необратимое ингибирование рецептора P2Y 12. Все они являются пролекарствами , которые необходимо преобразовать в активный метаболит in vivo для ингибирования рецептора P2Y 12. С другой стороны, новые препараты, такие как тикагрелор (Брилинта®) и кангрелор (Кенгрексал®), не являются тиенопиридинами и обратимо ингибируют P2Y 12, то есть они действуют непосредственно на рецептор без необходимости метаболической активации и демонстрируют более быстрое начало и окончание действия. [1] [2] [3] [4]
Эти препараты часто назначают в сочетании с аспирином (ацетилсалициловой кислотой) для усиления ингибирования тромбоцитов, особенно у пациентов с ОКС или перенесших чрескожное коронарное вмешательство (ЧКВ). [5]
До появления ингибиторов АДФ единственным антиагрегантным средством на рынке для лечения антитромботических событий был аспирин. Однако из-за повторяющихся ишемических событий у пациентов с высоким риском появилась основа для разработки антиагрегантных препаратов для воздействия на другие важные сигнальные пути. [5] [6]
История ингибиторов АДФ началась в 1972 году, когда исследователи искали препараты, похожие на противовоспалительное средство тиноридин, тиенопиридин с противовоспалительным и анальгезирующим действием, который был опубликован двумя годами ранее. [7] На основе знаний о химии тиенопиридина было синтезировано значительное количество производных тиенопиридинов. Производные были протестированы in vivo и ex vivo на мышах и крысах, но результаты тестов не продемонстрировали никаких противовоспалительных или анальгезирующих эффектов, но вместо этого они продемонстрировали неожиданные антиагрегантные и антитромботические эффекты. В то время было очень необычно проводить скрининг новых антиагрегантных средств, поскольку связь между агрегацией тромбоцитов, тромбозом и сердечно-сосудистыми инцидентами была спорной. Однако наиболее активное производное, тиклопидин, было выбрано для дальнейшей разработки. [7] Тиклопидин был тиенопиридином первого поколения, который усиливал ингибирование тромбоцитов и, таким образом, использовался для лечения in actue коронарного синдрома и других сердечно-сосудистых заболеваний. Из-за зарегистрированных тяжелых побочных эффектов тиклопидина были разработаны вторые и третьи тиенопиридины, клопидогрель и прасугрель. [5]
Когда тиклопидин и клопидогрель впервые появились на рынке, тиклодипин в 1978 году и клопидогрель в 1998 году, механизм действия этих двух основных антитромботических препаратов не был полностью понят. Было показано, что они являются мощными ингибиторами агрегации тромбоцитов, вызванной АДФ, но рецептор P2Y 12 не был идентифицирован. Кроме того, было ясно, что тиклопидин и клопидогрель являются пролекарствами, что означает, что они неактивны in-vitro и, следовательно, нуждаются в метаболизме для активации in-vivo. Только в 2000 году были выделены и охарактеризованы активные метаболиты этих препаратов. Примерно через год был идентифицирован тромбоцитарный рецептор P2Y 12 для АДФ. После этих открытий активные метаболиты и ферменты, ответственные за их образование, были постепенно идентифицированы. Таким образом, спустя более 30 лет после открытия тиклопидина и более 10 лет после открытия клопидогреля был объяснен механизм действия этих двух препаратов. [7]
Первые ингибиторы P2Y 12 были из семейства тиенопиридинов . Они являются непрямыми антагонистами, которые блокируют агрегацию и активацию тромбоцитов, вызванную АДФ. Первым препаратом этого класса был тиклопидин , который был открыт в 1972 году в Porcor (теперь Sanofi ). Он был открыт во время скрининга нового противовоспалительного препарата на основе тиноридина. Он был проверен с помощью фенотипического скринингового подхода, протестирован как in vivo, так и ex vivo на моделях грызунов . Он показал высокую антитромбоцитарную активность. [1]
Тиклопидин имел хорошие перспективы и был выбран для клинических испытаний. [1] Он был выпущен на рынок Франции в 1978 году и стал мировым препаратом в 1991 году, когда он появился на рынке США [7] для первичной и вторичной профилактики инсульта. [1]
Поиск другого аналога тиенопиридина с лучшим соотношением активности/ токсичности на животных начался сразу после того, как тиклопидин поступил в доклинические испытания . Поиск нового аналога стал еще более актуальным после сообщений о пациентах с тяжелыми гематологическими расстройствами из-за тиклопидина. [7]
Клопидогрель , тиенопиридин второго поколения, начал доклинические испытания в 1987 году и вышел на мировой рынок в 1998 году. Его механизм действия и его предшественника тиклопидина все еще были неизвестны. Единственное, что было известно, это то, что они являются пролекарствами, поскольку не проявляют никакой активности in vitro, что они необратимо влияют на тромбоциты из-за их длительной продолжительности действия, а активный метаболит химически и биологически нестабилен. Только в 2000 году был обнаружен активный метаболит, а его мишень для тромбоцитов была обнаружена годом позже, рецептор P2Y 12 АДФ. [7]
Хотя у клопидогреля соотношение активность/токсичность было лучше, чем у тиклопидина, все еще были проблемы с его активностью, так как у 30% пациентов наблюдалась резистентность к клопидогрелю. Основным фактором резистентности к клопидогрелю является полиморфизм CYP2C19 , который встречается у 30-55% пациентов. Это привело к потере функций фермента, что привело к плохому превращению клопидогреля в его активный метаболит. [1] Сам метаболит очень нестабилен и поэтому не может храниться как часть химической библиотеки . [7] Это привело к разработке соединения, которое в меньшей степени зависит от метаболизма, опосредованного CYP, прасугреля. [1]
Прасугрель, тиенопиридин третьего поколения, был выведен на рынок в 2009 году фармацевтическими компаниями Daiichi Sankyo/Eli Lilly. [1] Прасугрель, как и его предшественники, является пролекарством, но его метаболизм начинается в кишечнике, где он метаболизируется эстеразой в тиолактон, этот неактивный промежуточный продукт затем подвергается опосредованному CYP открытию кольца, в основном CYP3A4 и CYP2B6, в активный метаболит. Таким образом, прасугрель не подвержен резистентности к клопидогрелю. [8] [1]
Основное внимание было уделено поиску ингибитора P2Y 12 , который не является метаболитом и имеет более быстрое начало действия. Было известно, что АТФ конкурентно противодействует агрегации тромбоцитов, вызванной АДФ, однако АТФ очень нестабилен. Внимание было уделено созданию аналогов АТФ с более высокой эффективностью и стабильностью. Эти аналоги имели очень короткий период полураспада из-за сохранения трифосфатных групп и, таким образом, должны были вводиться внутривенно. Модификация этих аналогов привела к открытию тикагрелора, селективного и стабильного нефосфатного антагониста рецептора P2Y 12. [9] Тикагрелор относится к классу циклопентилтриазолопиримидина (CPTP). [10] Тикагрелор появился на рынке в 2010 году в Европе, [11] и в 2011 году в США. [12]
Кангрелор, другой аналог АТФ, как и тикагрелор, устойчив к ферментативной деградации. Он имеет быстрое начало действия, поскольку не распадается на активный метаболит, как тиенопиридины. [13] AstraZeneca получила эксклюзивную лицензию на кангрелор в декабре 2003 года. В 2009 году спонсор испытания фазы 3 вышел из игры, где кангрелор тестировался против плацебо. Разработка кангрелора была остановлена на время, когда спонсор вышел из игры после того, как временный комитет по рассмотрению анализа (IARC) решил, что испытание не покажет «убедительной» клинической эффективности, которая необходима для одобрения регулирующих органов. [14] Однако исследование Champion Phoenix (спонсируемое биофармацевтической компанией The Medicines Company), двойное слепое плацебо-контролируемое исследование, в котором 11 145 пациентов, которым проводилось довольно срочное или плановое ЧКВ, были случайным образом распределены для приема кангрелора или клопидогреля перед ЧКВ, показало, что кангрелор значительно снизил частоту ишемических событий во время ЧКВ. Кангрелор снизил развитие тромбоза стента больше, чем клопидогрель. Эти результаты были опубликованы в 2013 году. [15] Кангрелор получил одобрение FDA в июне 2015 года в качестве антиагрегантного препарата для внутривенного применения. [16]
Молекулярной мишенью активного метаболита ингибиторов рецептора АДФ является рецептор P2Y 12. [17] Рецептор P2Y 12 является G-сопряженным рецептором и активируется аденозиндифосфатом . АДФ связывается с рецептором P2Y 12 , что приводит к ингибированию аденилциклазы и тем самым снижает внутриклеточные уровни цАМФ. Это снижение цАМФ снижает фосфорилирование стимулированного вазодилататором фосфопротеина, что приводит к активации рецепторов гликопротеина IIb/IIIa . [18] Активация рецепторов гликопротеина IIb/IIIa увеличивает выработку тромбоксана и пролонгирует агрегацию тромбоцитов. [19] Тиклопидин, клопидогрель и прасугрель являются тиенопиридиновыми пролекарствами, которые являются необратимыми ингибиторами тромбоцитов рецептора P2Y 12 . Кангрелор и тикагрелор являются ингибиторами P2Y 12 прямого действия , которые изменяют конформацию рецептора P2Y 12 и, следовательно, вызывают обратимое ингибирование тромбоцитов рецептора. Тиенопиридины метаболизируются в печени и кишечнике до активных метаболитов. [20]

Тиклопидин является пролекарством и метаболизируется по крайней мере пятью основными путями. Существует один активный метаболит, который был идентифицирован и, как было показано, обладает антиагрегантной активностью. Этот активный метаболит образуется по CYP-зависимому пути. CYP2C19 и CYP2B6 являются ферментами, предположительно способствующими метаболическому превращению тиклопидина в промежуточный продукт тиолактона , 2-оксо-тиклопидин в печени. Затем промежуточный продукт тиолактона преобразуется в активный метаболит тиклопидина через окисление CYP, где происходит активация окисления . Однако ферменты CYP , которые участвуют в этом пути, неизвестны. [20] При образовании активного метаболита были идентифицированы дополнительные метаболиты, и это метаболиты дигидротиенопиридиния (M5) и тиенодигидропиридиния (M6). Эти метаболиты могут быть ответственны за токсические побочные эффекты тиклопидина. [18]
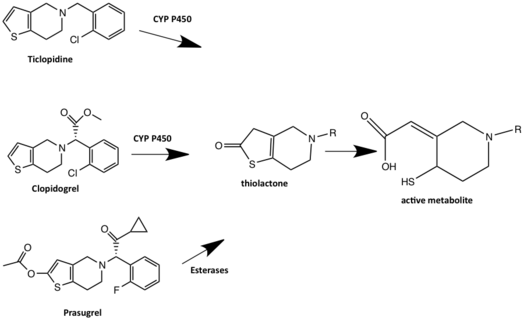
Клопидогрель является пролекарством, которое метаболизируется двумя путями. В одном из путей большая часть дозы клопидогреля (85%) гидролизуется эстеразами до неактивного производного карбоновой кислоты и быстро выводится посредством глюкоридирования с последующей почечной экскрецией . Другой путь клопидогреля требует двухэтапной печеночной метаболической активации CYP450 для получения активного метаболита, который ингибирует рецептор P2Y 12. CYP1A2, CYP3A4, CYP3A5 и CYP2C19 считаются основными ферментами, участвующими в метаболизме клопидогреля. [ 19] Сначала клопидогрель метаболизируется в 2-оксо-клопидогрель, который, в свою очередь, гидролизуется до активного метаболизма, который представляет собой тиол . Тиол образует дисульфидный мостик с цистеином в рецепторе P2Y 12 и, таким образом, необратимо связывается с рецептором P2Y 12. Предполагается, что клопидогрель ковалентно связывается с CYS17 или CYS270 рецептора P2Y 12 и, следовательно, блокирует связывание агониста. [18] У некоторых пользователей клопидогреля наблюдается дефектная активность CYP2C19 и, следовательно, плохой метаболизм CYP2C19, что приводит к риску снижения активности клопидогреля. Это происходит потому, что пролекарство не метаболизируется в активное лекарство. Лекарства, являющиеся ингибиторами CYP2C19, могут взаимодействовать с клопидогрелем и снижать активность клопидогреля. Все ингибиторы протонной помпы, за исключением рабепразола и пантопразола, метаболизируются печеночным ферментом CYP450 и, следовательно, могут взаимодействовать с метаболизмом клопидогреля. Считается, что омепразол имеет более высокий потенциал взаимодействия с другими препаратами, чем другие ингибиторы белкового насоса, поскольку он является ингибитором CYP2C19. [17]
Прасугрель — это тиенопиридин третьего поколения и пролекарство. В отличие от тиклопидина и клопидогреля, активация прасугреля включает гидролиз до промежуточного тиолактона , который затем преобразуется в активный метаболит в один CYP-зависимый шаг. Активный метаболит, который является R-138727 (тиоловый промежуточный), либо необратимо связывается с рецептором P2Y 12 , либо метаболически метилируется до неактивного метаболита. R-138727 метаболически инактивируется посредством S-метилирования. Прасугрель не метаболизируется CYP2C19, как клопидогрель, и генетические варианты CYP не оказывают существенного влияния на активные метаболиты прасугреля. Прасугрель имеет более быстрое начало действия и большую блокировку рецепторов активным метаболитом, чем клопидогрель. [18]
Тикагрелор был первым обратимым ингибитором рецептора P2Y 12 , активным после перорального приема. Тикагрелор активен перорально без необходимости какой-либо метаболической активации. Он быстро всасывается и подвергается ферментативному расщеплению по крайней мере до одного активного метаболита, который почти так же эффективен, как и его исходное соединение. Тикагрелор имеет улучшенные фармакокинетические и фармакодинамические профили по сравнению с имеющимися в настоящее время препаратами для лечения ОКС. Более того, генотипы CYP2C19 , которые, как известно, влияют на эффект клопидогреля, не повлияли на эффект тикагрелора. [19]
Кангрелор — первый обратимый ингибитор P2Y 12 , который можно вводить внутривенно, и который имеет очень быстрое начало и окончание действия, что может обеспечить преимущества по сравнению с существующими препаратами и позволить кангрелору преодолеть эти ограничения перорального ингибитора P2Y 12. Это делает его привлекательным вариантом для антиагрегантной терапии, особенно для пациентов, которые не могут принимать пероральные препараты (например, пациенты без сознания, с рвотой или в состоянии седации). Как и тикагрелор, он не требует метаболического преобразования для активации и, следовательно, может напрямую ингибировать рецептор P2Y 12. [21]
Прасугрель был разработан с учетом метаболизма. Это было сделано путем замены эфирной группы на метаболически стабильный кетон (группа R1). Также добавление эфирной группы в положение тиофена 2 (группа R2) сместило первый этап активации с CYP2C19 на эстеразы и, следовательно, прасугрель не метаболизируется CYP2C19, как клопидогрель. [22]

Кангрелор и тикагрелор — это новые классы обратимых рецепторов P2Y 12 , которые были разработаны для решения проблем безопасности (кровотечения) и невосприимчивости, которые характерны для тиенопиридинов. Было показано, что природные лиганды, такие как аденозинтрифосфат ( АТФ ), ингибируют агрегацию тромбоцитов и были идентифицированы как слабые антагонисты . Кангрелор и тикагрелор — это аналоги нуклеотидов , имеющие химическую структуру , напоминающую аденозинтрифосфат (АТФ). [21] АТФ может метаболизироваться в сердечно-сосудистых тканях до проагрегационного АДФ, АМФ или аденозина. Замена ангидридного кислорода между фосфором β (Pβ) и фосфором γ (Pγ) на дихлоро или дифторметилен приводит к соединению, которое равносильно АТФ и имеет схожую pKa . Из-за этой замены можно избежать метаболизма АТФ в проагрегационный. Добавление S-пропила в длину цепи оказало большое влияние на активность. Добавление монозамещенного алкиламина в положение C4 аденозина привело к десятикратному увеличению активности, а также длина заместителя алкиламина коррелировала со смещением эффекта. Добавление метилсульфанилэтиламиногруппы в положение C4 и трифторпропилсульфанила в длину цепи приводит к образованию препарата кангрелор, который обладает повышенной активностью. Кангрелор имеет 78% среднее восстановление агрегации тромбоцитов, вызванной АДФ, у крыс через 20 минут по сравнению с соединением 1C, которое имеет менее 10% восстановление. [22]
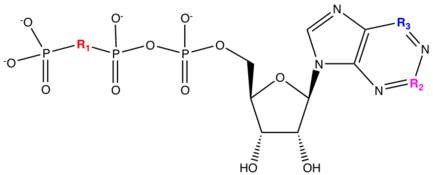
Для удовлетворения потребности в обратимом пероральном препарате тикагрелор фосфатная цепь кангрелора была заменена аспарагиновой кислотой , что привело к 300-кратному снижению активности. Активность тикагрелора была возвращена к тому же уровню, что и у кангрелора, путем замены пурина на триазолопиримидин. Сахарная рибозная единица также была заменена циклопентильной группой, чтобы избежать возможной нестабильности гликозидной связи . Группа в левой части структуры была заменена на сайдкаин R1. Нейтральная боковая цепь R1=CONH2 и R1= CH2OH была принята с небольшой потерей сродства, и метаболизм сместился с билиарного на печеночный . Из-за этого можно было использовать печеночные микросомальные анализы in vitro , что упростило оптимизацию фармакокинетических свойств. Добавление заместителя фенилциклопропиламина в 5-е положение дало высокое сродство. Из этого было обнаружено, что первое соединение имеет измеримую пероральную биодоступность у крыс (R1 = CH 2 OH). Изменение R2 оказало незначительное влияние на сродство, что позволило ввести группы для улучшения фармакокинетических свойств, например, R1 = OCH 2 CH 2 OH. Введение фторидов в фенильное кольцо и в конец алкильной цепи тиоэфира приводит к дальнейшему улучшению метаболической стабильности. Заменив фториды в алкильной цепи тиоэфира обратно на S-пропил, мы получаем формулу тикагрелора. [22]

Активация тромбоцитов и последующая агрегация тромбоцитов играют решающую роль в поддержании нормального гемостаза . Нарушение в этой системе может привести к цереброваскулярным , сердечно-сосудистым и периферическим сосудистым заболеваниям , где это может привести к инсульту, нестабильной стенокардии и инфаркту миокарда. При повреждении сосуда АДФ высвобождается из поврежденных клеток и активированных тромбоцитов, вызывая дальнейшую агрегацию тромбоцитов. [23] [24]
Блокатор тиенопиридиновых рецепторов P2Y 12 первого поколения тиклопидин был выведен из клинического использования после высокой частоты побочных эффектов, таких как тромботическая тромбоцитопеническая пурпура , апластическая анемия и нейтропения . [25] Клиническое использование препарата было быстро вытеснено клопидогрелем, поскольку последний имел меньше желудочно-кишечных побочных эффектов и лучшую гематологическую безопасность. [26]
Блокатор тиенопиридиновых рецепторов P2Y 12 второго поколения клопидогрель является эффективным антиагрегантным средством, полезным для лечения ишемического цереброваскулярного, сердечного и периферического артериального выброса. [27] Как и другие тиенопиридиновые препараты, препарат часто сочетался с аспирином в клинической практике. [23] Клинически одобренная дозировка клопидогреля составляет 300 мг ударной дозы перорально и 75 мг в день поддерживающей дозы перорально. [28]
В течение многих лет двойное лечение ингибитором циклооксигеназы-1 (ЦОГ-1) аспирином и клопидогрелем было обычной практикой и служило основными антиагрегантными средствами для профилактики тромботических событий, поскольку они обладают способностью мощно манипулировать биологией тромбоцитов, которая играет центральную роль в тромбозе. Однако использование этих средств по-прежнему сопряжено с рядом важных ограничений, таких как подверженность повышенному риску кровотечения , что делает продолжительность и дозировку клопидогреля важнейшими. Кроме того, реакция на клопидогрель неравномерна, а слабая реакция может привести к серьезным неблагоприятным сердечно-сосудистым событиям . [29] [30]
Новое поколение блокаторов P2Y 12 направлено на решение этих проблем, обещая улучшение результатов для пациентов. Эти недавно разработанные блокаторы P2Y 12 (тикагрелор, кангрелор, прасугрель и элиногрель) обеспечивают более последовательное и сильное ингибирование тромбоцитов за счет более эффективного противодействия рецептору P2Y 12. Однако это более мощное ингибирование тромбоцитов достигается за счет более высокого риска кровотечения. [31] [29]
Прасугрель, тиенопиридин третьего поколения, метаболизируется в организме эффективнее, чем клопидогрель и тиклопидин, и поэтому он в большей степени предотвращает активацию тромбоцитов. Исследования показали, что прасугрель снижает риск тромбоза стента и инфаркта миокарда в гораздо большей степени, чем клопидогрель. [26] Клинически одобренная доза прасугреля составляет 60 мг ударной дозы перорально и 10 мг в день поддерживающей дозы перорально. [28]
Тикагрелор является гораздо более мощным ингибитором агрегации тромбоцитов, чем клопидогрель, однако он связан с увеличением эпизодов одышки у пациентов. Эти эпизоды могут варьироваться от легкой до умеренной степени тяжести. Одобренная клиническая дозировка тикагрелора составляет 180 мг ударной дозы перорально и 90 мг в день поддерживающей дозы. [32]
Единственным исходным препаратом, воздействующим на рецептор P2Y 12 и применяемым в клинической практике, является кангрелор. [33]
Фермент CYP2C19 метаболизирует ингибиторы протонной помпы (ИПП), а также клопидогрель. В различных отчетах говорилось, что существует отрицательное взаимодействие между клопидогрелем и омепразолом . Некоторые исследования показали, что активность клопидогреля на тромбоцитах была значительно затруднена у пациентов, получавших лечение омепразолом , ингибитором протонной помпы (ИПП). [34] [35] Другое исследование также показало, что лансопразол оказывает препятствующее действие на активность клопидогреля. [36] Однако другие исследования показали, что прием пантопразола или эзомепразола из ИПП не связан с ухудшением ответа на клопидогрель. [35] [37]
В 2009 году Управление по контролю за продуктами и лекарствами США ( FDA ) и Европейское агентство по лекарственным средствам (EMA) не рекомендовали комбинацию клопидогреля и ИПП, особенно омепразола, из-за наблюдений, сделанных в то время в ходе начальных когортных исследований. Однако более новые ретроспективные когортные исследования не показали неблагоприятных сердечно-сосудистых событий, вызванных взаимодействием клопидогреля и ИПП. Поэтому нет определенных доказательств влияния взаимодействия препаратов на смертность. [38]
Для пациентов с высоким риском желудочно-кишечного кровотечения риск перевешивает возможные неблагоприятные сердечно-сосудистые эффекты. Поэтому следует рекомендовать этим пациентам комбинировать клопидогрель с менее ингибирующими CYP2C19 ИПП, такими как пантопразол. [38]
Резистентность к клопидогрелю появилась на протяжении многих лет и стала большой проблемой для терапии пациентов с ОКС или перенесших ЧКВ. Сообщается, что резистентность к клопидогрелю варьируется от 4 до 44% между различными популяциями и этническими группами. Пациенты, которые подвергаются резистентности к клопидогрелю, демонстрируют более низкую активность ингибирования тромбоцитов из-за снижения уровней активного метаболита клопидогреля. Это приводит к серии клинических инцидентов, например, ишемических и тромбоэмболических осложнений. Эти пациенты признаются плохо или не реагирующими на терапию. [39] [40]
Клопидогрель — это пролекарство, которому требуется двухэтапная метаболизация с помощью ферментов, чтобы стать активным метаболитом. Одним из важнейших ферментов в метаболизме клопидогреля является CYP2C19, который участвует в обоих этапах биотрансформации. Полиморфизм фермента CYP2C19 влияет на реакцию на клопидогрель, тем самым снижая ферментативную активность и, следовательно, уменьшая активный метаболит клопидогреля. [40]
Основной проблемой резистентности к клопидогрелю является взаимодействие с другими препаратами, особенно с ингибитором протонной помпы омепразолом. Омепразол и клопидогрель метаболизируются одним и тем же метаболическим путем CYP. Следовательно, было высказано предположение, что низкая чувствительность клопидогреля при одновременном применении с омепразолом вызвана конкуренцией фермента CYP2C19 между этими двумя препаратами. [40]
Клинические подходы к преодолению резистентности к клопидогрелю включают более высокие дозы клопидогреля, сопутствующее использование с ингибитором фосфодиэстеразы цилостазолом или переключение на новый антиагрегант, такой как прасугрель и тикагрелор. Тем не менее, основной проблемой этих методов является повышенный риск кровотечения. Поэтому потребность в новом антиагреганте с быстрым началом действия, меньшей вариабельностью реакции среди людей и улучшенным профилем безопасности имеет решающее значение. [39]
Разработка ингибиторов АДФ постоянно совершенствуется, и поиск еще лучших антагонистов P2Y 12 все еще продолжается. [1] Краеугольным камнем вторичной профилактики атеротромботических событий у пациентов с ОКС или перенесших ЧКВ является двойная антиагрегантная терапия аспирином и клопидогрелем. Тем не менее, события атеротромбоза все еще происходят. [41] Ограничения современных антиагрегантных препаратов включают риск кровотечения и межиндивидуальную изменчивость ингибирующего ответа тромбоцитов. [6]
Цель состоит в том, чтобы определить оптимальное терапевтическое окно для максимизации терапевтических преимуществ при одновременном снижении проблем безопасности, таких как кровотечение. Следовательно, основная невыполненная цель ингибиторов АДФ заключается в разработке мощного обратимого антиагрегантного агента с быстрым началом действия, высоким уровнем антиагрегантной активности и сниженным риском кровотечений. Эта сложная цель вместе с профилем приема один раз в день и оптимизированной селективностью цели, возможно, станет важным прорывом в этой области. [1] [39]
Викагрел является последней разработкой, по состоянию на сентябрь 2017 года, в этом секторе. Новый ацетатный аналог клопидогреля, который, как ожидается, достигнет улучшенной антитромбоцитарной эффективности, а также снижения риска кровотечения. [42] Предварительные фармакокинетические исследования викагрела показали более высокую биодоступность, чем у клопидогреля, что указывает на гораздо более низкую терапевтическую эффективную дозу для викагрела. Преимуществами викагрела перед клопидогрелем считаются отсутствие лекарственной резистентности для слабых метаболизаторов CYP2C19, снижение дозозависимой токсичности из-за более низкой эффективной дозы и более быстрого начала действия . [39]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )[ нужна страница ]{{cite book}}: CS1 maint: местоположение отсутствует издатель ( ссылка ) CS1 maint: несколько имен: список авторов ( ссылка )[ нужна страница ]