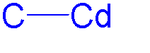
Химия кадмия органического описывает физические свойства, синтез, реакции и использование кадмиевоорганических соединений , которые являются металлоорганическими соединениями , содержащими химическую связь углерода с кадмием . [1] Кадмий делит группу 12 с цинком и ртутью , и их соответствующие химические свойства имеют много общего. Синтетическая полезность кадмиеорганических соединений ограничена.
Простейшим кадмиевоорганическим соединением является диметилкадмий . Это линейная молекула с длиной связи C-Cd 213 пм . [2] Кадмиевоорганические соединения обычно чувствительны к воздуху, свету и влаге.
Диметилкадмий и диэтилкадмий были описаны в 1917 году Эрихом Краузе. В общем, их получают путем трансметаллирования или реакцией обмена между алкилирующим агентом и солью кадмия. [3]
Согласно одной из процедур, диэтилкадмий получают реакцией бромида кадмия с двумя эквивалентами реактива Гриньяра этилмагнийбромида в диэтиловом эфире . Диэтилкадмий представляет собой бесцветное масло с температурой плавления -21 °C . Дифенилкадмий можно получить реакцией фениллития с бромидом кадмия. Дифенилкадмий представляет собой твердое вещество с температурой плавления 174 °C.
Следуя установленным тенденциям, перфторированные алкильные и алкенильные производные кадмия демонстрируют улучшенную термическую стабильность. Алкенильные производные получаются путем добавления иодтрифторэтилена к металлическому кадмию. [4]
Кадмиевоорганические соединения менее нуклеофильны, чем цинкорганические . Эта пониженная реакционная способность продемонстрирована при превращении ацилхлоридов в кетоны с этими реагентами. [5] Эта реакция была описана Генри Гилманом в 1936 году и использовалась до тех пор, пока не стали доступны менее токсичные купраты. Родственный реагент Гриньяра будет реагировать дальше, давая третичный спирт . Метилкадмий использовался на одном из этапов, ведущих к общему синтезу холестерина : [6]
Другим синтетическим применением органокадмия является реакция диизоамилкадмия с β-карбометоксипропионилхлоридом с образованием метил 4-кето-7-метилоктаноата без дальнейшей реакции с кетонной группой или сложноэфирной группой. [7]
Эта селективность наблюдается при условии, что реакция проводится без соли. [8] Когда кадмиевый реагент генерируется in situ из соли кадмия, галогенид генерирует более нуклеофильный кадмиевоорганический реагент, атный комплекс . Тот же солевой эффект можно наблюдать с цинкорганическими соединениями.
Диметилкадмий использовался для синтеза коллоидных нанокристаллов материалов II-VI, таких как селенид кадмия . Его токсичная и летучая природа побудила исследователей искать другие источники предшественников кадмия, такие как оксид кадмия. [9]
Соединения кадмия токсичны. Диметилкадмий токсичен для почек, печени, центральной нервной системы и органов дыхания при вдыхании. [10] Соединения кадмия в целом считаются канцерогенами для человека по данным МАИР . [11]
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка )