
Диол — это химическое соединение , содержащее две гидроксильные группы ( группы −ОН ). [1] Алифатический диол также может называться гликолем . [2] Это спаривание функциональных групп широко распространено, и было выявлено множество подкатегорий. Они используются в качестве защитных групп карбонильных групп , что делает их необходимыми в синтезе органической химии. [3]
Наиболее распространенным промышленным диолом является этиленгликоль . Примерами диолов, в которых гидроксильные функциональные группы более широко разделены, являются 1,4-бутандиол HO−(CH 2 ) 4 −OH и пропилен-1,3-диол , или бета-пропиленгликоль, HO−CH 2 −CH 2 −CH 2 −OH .
Геминальный диол имеет две гидроксильные группы, связанные с одним и тем же атомом. Эти виды возникают в результате гидратации карбонильных соединений. Гидратация обычно неблагоприятна, но заметным исключением является формальдегид , который в воде существует в равновесии с метандиолом H 2 C(OH) 2 . [4] Другим примером является (F 3 C) 2 C(OH) 2 , гидратированная форма гексафторацетона . Многие гем-диолы подвергаются дальнейшей конденсации с образованием димерных и олигомерных производных. Эта реакция применима к глиоксалю и родственным альдегидам .
В вицинальном диоле две гидроксильные группы занимают вицинальные положения, то есть они присоединены к соседним атомам. Эти соединения называются гликолями [5] (хотя этот термин может использоваться и более широко). Примерами являются этан-1,2-диол или этиленгликоль HO−(CH 2 ) 2 −OH, распространенный ингредиент антифризов . Другим примером является пропан-1,2-диол или альфа-пропиленгликоль, HO−CH 2 −CH(OH)−CH 3 , используемый в пищевой и медицинской промышленности, а также относительно неядовитый антифриз.
В коммерческих масштабах основным путем получения вицинальных диолов является гидролиз эпоксидов . Эпоксиды получают эпоксидированием алкена. Примером может служить синтез транс-циклогександиола [6] или микрореактор : [7]
Для академических исследований и фармацевтических областей вицинальные диолы часто производятся путем окисления алкенов , обычно с помощью разбавленного кислотного перманганата калия или тетроксида осмия. [8] Тетроксид осмия может быть аналогичным образом использован для окисления алкенов до вицинальных диолов. Химическая реакция, называемая асимметричным дигидроксилированием Шарплесса , может быть использована для получения хиральных диолов из алкенов с использованием реагента осмата и хирального катализатора . Другой метод — цис-гидроксилирование Вудворда (цис-диол) и связанная с ним реакция Прево (анти-диол), в которых оба используют иод и серебряную соль карбоновой кислоты.
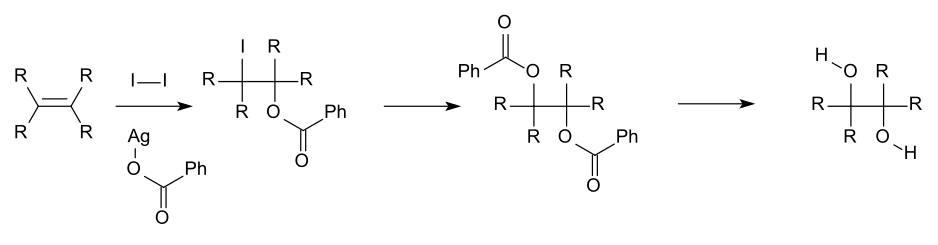
Другими путями получения вик-диолов являются гидрирование ацилоинов [9] и реакция сочетания пинакола .
1,3-Диолы часто получают в промышленности путем альдольной конденсации кетонов с формальдегидом . Вы можете использовать множество различных исходных материалов для получения син- или анти-1,3-диолов. [10] Полученный карбонил восстанавливают с помощью реакции Канниццаро или путем каталитического гидрирования :
Таким образом получают 2,2-дизамещенные пропан-1,3-диолы. Примерами являются 2-метил-2-пропил-1,3-пропандиол и неопентилгликоль .
1,3-Диолы могут быть получены путем гидратации α,β-ненасыщенных кетонов и альдегидов. Полученный кето-спирт гидрогенизируется. Другой путь включает гидроформилирование эпоксидов с последующим гидрогенизацией альдегида. Этот метод был использован для 1,3-пропандиола из этиленоксида .
Более специализированные пути получения 1,3-диолов включают реакцию между алкеном и формальдегидом , реакцию Принса . 1,3-диолы можно получать диастереоселективно из соответствующих β-гидроксикетонов с использованием протоколов восстановления Эванса–Саксены , Нарасаки–Прасада или Эванса–Тищенко .
1,3-Диолы описываются как син- или анти- в зависимости от относительной стереохимии атомов углерода, несущих гидроксильные функциональные группы. Цинкофорин — это натуральный продукт , который содержит как син- , так и анти -1,3-диолы.

Диолы, в которых гидроксильные группы разделены несколькими углеродными центрами, обычно получают путем гидрирования диэфиров соответствующих дикарбоновых кислот :
1,4-бутандиол , 1,5-пентандиол , 1,6-гександиол , 1,10-декандиол являются важными предшественниками полиуретанов . [11]
С промышленной точки зрения, доминирующие реакции диолов происходят при производстве полиуретанов и алкидных смол . [11]
Диолы реагируют как спирты , путем этерификации и образования эфира . [12]
Диолы, такие как этиленгликоль, используются в качестве сомономеров в реакциях полимеризации , образующих полимеры , включая некоторые полиэфиры и полиуретаны . [12] Для продолжения процесса полимеризации посредством повторяющихся процессов этерификации требуется другой мономер с двумя идентичными функциональными группами, такой как диоилдихлорид или дикарбоновая кислота.
Диол можно преобразовать в циклический эфир, используя кислотный катализатор, это диольная циклизация. Во-первых, она включает протонирование гидроксильной группы. Затем, после внутримолекулярного нуклеофильного замещения, вторая гидроксильная группа атакует электронодефицитный углерод. При условии, что имеется достаточно атомов углерода, так что угловое напряжение не слишком велико, может образоваться циклический эфир.

1,2-диолы и 1,3-диолы можно защитить с помощью защитной группы. [13] Защитные группы используются для того, чтобы функциональная группа не реагировала на будущие реакции. Бензилиденовые группы используются для защиты 1,3-диолов. [13] Существуют чрезвычайно полезные в биохимии, как показано ниже, производные углеводов защищены.

Диолы также могут использоваться для защиты карбонильных групп. [14] Они широко используются и весьма эффективны при синтезе циклических ацеталей. Они защищают карбонильные группы от реакции в ходе дальнейшего синтеза до тех пор, пока не возникнет необходимость их удалить. Реакция ниже показывает, как диол используется для защиты карбонила с использованием тетрахлорида циркония. [15]
Диолы также можно преобразовать в лактоны с помощью реакции окисления Фетизона .
При расщеплении гликоля связь C−C в вицинальном диоле расщепляется с образованием функциональных групп кетона или альдегида. См. Окисление диола .
В целом органические геминальные диолы легко дегидратируются с образованием карбонильной группы .