Тетрагидропиран ( ТГП ) — органическое соединение , состоящее из насыщенного шестичленного кольца, содержащего пять атомов углерода и один атом кислорода. Он назван в честь пирана , который содержит две двойные связи и может быть получен из него добавлением четырех атомов водорода. В 2013 году его предпочтительное название IUPAC было установлено как оксан . [1] Соединение представляет собой бесцветную летучую жидкость. Однако более распространены производные тетрагидропирана. Эфиры 2-тетрагидропиранила (ТГП-), полученные в результате реакции спиртов и 3,4-дигидропирана, обычно используются в качестве защитных групп в органическом синтезе . [2] Кроме того, тетрагидропирановая кольцевая система , то есть пять атомов углерода и кислород, является ядром пиранозных сахаров, таких как глюкоза .
В газовой фазе THP существует в конформации кресла симметрии C с наименьшей энергией . [3]
Одной из классических процедур органического синтеза тетрагидропирана является гидрирование 3,4 - изомера дигидропирана никелем Ренея . [4]
Хотя тетрагидропиран является малоизвестным соединением, эфиры тетрагидропиранила широко используются в органическом синтезе . В частности, 2-тетрагидропиранильная группа (THP) является обычной защитной группой для спиртов . [5] [6] Спирты реагируют с 3,4-дигидропираном с образованием 2-тетрагидропираниловых эфиров. Эти эфиры устойчивы к различным реакциям. Позже спирт можно восстановить путем кислотно-катализируемого гидролиза . В результате гидролиза преобразуется исходный спирт, а также 5-гидроксипентаналь. Эфиры ТНР, полученные из хиральных спиртов, образуют диастереомеры. Еще одной нежелательной особенностью является то, что эфиры имеют сложные спектры ЯМР, которые мешают анализу. [2]
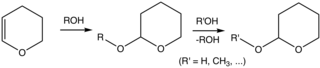
В типичной процедуре спирт обрабатывают 3,4-дигидропираном и п -толуолсульфоновой кислотой в дихлорметане при температуре окружающей среды. [2]

Альтернативно, простой эфир THP может быть получен в условиях, аналогичных условиям реакции Мицунобу . Таким образом, спирт обрабатывают 2-гидрокситетрагидропиранилом, трифенилфосфином и диэтилазодикарбоксилатом (DEAD) в тетрагидрофуране (ТГФ).
Обычно с эфиров THP снимают защиту с помощью уксусной кислоты в растворе ТГФ/воды, п -толуолсульфокислоты в воде или п- толуолсульфоната пиридиния (ППТС) в этаноле .
Оксаны представляют собой класс гексациклических эфирных колец с тетрагидропираном в качестве основного химического вещества. В оксанах один или несколько атомов углерода заменены атомом кислорода. [8] Предпочтительное название тетрагидропирана по ИЮПАК теперь — оксан . [9]