Клеточные соединения [1] или соединительные комплексы представляют собой класс клеточных структур, состоящих из мультипротеиновых комплексов , которые обеспечивают контакт или адгезию между соседними клетками или между клеткой и внеклеточным матриксом у животных. [2] Они также поддерживают парацеллюлярный барьер эпителия и контролируют парацеллюлярный транспорт . Клеточные соединения особенно распространены в эпителиальных тканях. В сочетании с молекулами клеточной адгезии и внеклеточным матриксом клеточные соединения помогают удерживать клетки животных вместе.
Клеточные соединения также особенно важны для обеспечения связи между соседними клетками посредством специализированных белковых комплексов, называемых коммуникативными (щелевыми) соединениями . Клеточные соединения также важны для снижения нагрузки на клетки.
У растений подобные каналы связи известны как плазмодесмы , а у грибов они называются септальными порами . [3]

У позвоночных существует три основных типа клеточных соединений:
У беспозвоночных есть несколько других типов специфических соединений, например, септированные соединения или апикальное соединение C. elegans . У многоклеточных растений структурные функции клеточных соединений обеспечиваются клеточными стенками . Аналоги коммуникативных клеточных соединений у растений называются плазмодесмами .
Клетки в тканях и органах должны быть прикреплены друг к другу и к компонентам внеклеточного матрикса . Клетки развили несколько типов соединительных комплексов для выполнения этих функций, и в каждом случае закрепляющие белки простираются через плазматическую мембрану, чтобы связать цитоскелетные белки в одной клетке с цитоскелетными белками в соседних клетках, а также с белками во внеклеточном матриксе. [5]
Наблюдаются три типа якорных соединений , которые отличаются друг от друга цитоскелетным белком-якорем, а также трансмембранным линкерным белком, который простирается через мембрану:
Соединения якорного типа не только удерживают клетки вместе, но и обеспечивают тканям структурную связность. Эти соединения наиболее распространены в тканях, которые подвергаются постоянному механическому напряжению, таких как кожа и сердце. [5]

Десмосомы, также называемые maculae attachedtes, можно визуализировать как заклепки через плазматическую мембрану соседних клеток. Промежуточные филаменты, состоящие из кератина или десмина , прикреплены к мембранно-ассоциированным белкам прикрепления, которые образуют плотную бляшку на цитоплазматической поверхности мембраны. Молекулы кадгерина образуют фактический якорь, прикрепляясь к цитоплазматической бляшке, простираясь через мембрану и прочно связываясь с кадгеринами, проходящими через мембрану соседней клетки. [6]
Гемидесмосомы образуют заклепочные связи между цитоскелетом и компонентами внеклеточного матрикса, такими как базальные пластинки , лежащие под эпителием. Подобно десмосомам, они прикрепляются к промежуточным филаментам в цитоплазме, но в отличие от десмосом их трансмембранными якорями являются интегрины, а не кадгерины. [7]
Адгезивные соединения имеют общую характеристику закрепления клеток посредством их цитоплазматических актиновых филаментов . Подобно десмосомам и гемидесмосомам, их трансмембранные якоря состоят из кадгеринов в тех, которые закреплены на других клетках, и интегринов (фокальная адгезия) в тех, которые закреплены на внеклеточном матриксе. Существует значительное морфологическое разнообразие среди адгезивных соединений. Те, которые связывают клетки друг с другом, видны как изолированные полоски или пятна, или как полосы, которые полностью окружают клетку. Ленточный тип адгезивных соединений связан с пучками актиновых филаментов, которые также окружают клетку чуть ниже плазматической мембраны. Точечные адгезивные соединения, называемые фокальными адгезиями, помогают клеткам прилипать к внеклеточному матриксу. Цитоскелетные актиновые филаменты, которые закреплены в адгезивных соединениях, являются сократительными белками, и в дополнение к обеспечению функции закрепления, адгезивные соединения, как полагают, участвуют в складывании и изгибе эпителиальных клеточных пластов. Представление о полосах актиновых филаментов как о «шнурках» позволяет представить, как сокращение полос внутри группы клеток может деформировать слой, создавая интересные узоры. [5]
Щелевые контакты или сообщающиеся контакты обеспечивают прямую химическую связь между соседними цитоплазмами клеток посредством диффузии без контакта с внеклеточной жидкостью. [8] Это возможно благодаря шести белкам коннексина, взаимодействующим с образованием цилиндра с порой в центре, называемого коннексоном . [9] Комплексы коннексонов простираются через клеточную мембрану, и когда взаимодействуют два соседних клеточных коннексона, они образуют полный канал щелевого контакта. [8] [9] Поры коннексонов различаются по размеру, полярности и, следовательно, могут быть специфичными в зависимости от белков коннексина, которые составляют каждый отдельный коннексон. [8] [9] Хотя изменения в каналах щелевых контактов действительно происходят, их структура остается относительно стандартной, и это взаимодействие обеспечивает эффективную связь без утечки молекул или ионов во внеклеточную жидкость. [9]
Щелевые контакты играют жизненно важную роль в организме человека, [10] включая их роль в равномерном сокращении сердечной мышцы . [10] Они также важны для передачи сигналов в мозге , и их отсутствие показывает снижение плотности клеток в мозге. [11] Клетки сетчатки и кожи также зависят от щелевых контактов в дифференциации и пролиферации клеток. [10] [11]
Плотные контакты, обнаруженные в эпителии позвоночных , действуют как барьеры, регулирующие движение воды и растворенных веществ между эпителиальными слоями. Плотные контакты классифицируются как парацеллюлярный барьер, который определяется как не имеющий направленной дискриминации; однако движение растворенного вещества во многом зависит от размера и заряда. Есть данные, позволяющие предположить, что структуры, через которые проходят растворенные вещества, чем-то похожи на поры.
Физиологический pH играет роль в селективности растворов, проходящих через плотные контакты, при этом большинство плотных контактов являются слегка селективными для катионов. Плотные контакты, присутствующие в различных типах эпителия, селективны для растворов разного размера, заряда и полярности.
Было идентифицировано около 40 белков, которые участвуют в плотных контактах. Эти белки можно разделить на четыре основные категории: сигнальные белки.
Считается, что клаудин — это белковая молекула, отвечающая за избирательную проницаемость между эпителиальными слоями.
Трехмерное изображение еще не получено, и поэтому конкретная информация о функции плотных контактов еще не получена.
Трехклеточные соединения запечатывают эпителий в углах трех клеток. Из-за геометрии трехклеточных вершин запечатывание клеток в этих местах требует особой организации соединений, отличной от таковой в двухклеточных соединениях. У позвоночных компонентами трехклеточных соединений являются трицеллюлин и стимулируемые липолизом липопротеиновые рецепторы. У беспозвоночных компонентами являются глиотактин и анаконда. [12]
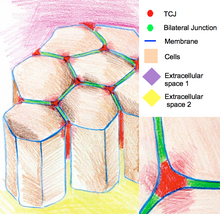
Триклеточные соединения также участвуют в регуляции организации цитоскелета и деления клеток. В частности, они обеспечивают деление клеток в соответствии с правилом Гертвига . В некоторых эпителиях Drosophila во время деления клеток триклеточные соединения устанавливают физический контакт с веретенным аппаратом через астральные микротрубочки. Триклеточные соединения оказывают тяговое усилие на веретенный аппарат и служат геометрической подсказкой для определения ориентации клеточных делений. [13]
Молекулы, ответственные за создание клеточных соединений, включают различные молекулы клеточной адгезии . Существует четыре основных типа: селектины , кадгерины , интегрины и суперсемейство иммуноглобулинов . [14]
Селектины — это молекулы клеточной адгезии, которые играют важную роль в инициировании воспалительных процессов. [15] Функциональная способность селектина ограничена взаимодействием лейкоцитов с сосудистым эндотелием. У людей обнаружено три типа селектинов: L-селектин, P-селектин и E-селектин. L-селектин взаимодействует с лимфоцитами, моноцитами и нейтрофилами, P-селектин взаимодействует с тромбоцитами и эндотелием, а E-селектин взаимодействует только с эндотелием. Они имеют внеклеточные области, состоящие из аминоконцевого лектинового домена, прикрепленного к углеводному лиганду, домену, подобному фактору роста, и коротким повторяющимся единицам (пронумерованные кружки), которые соответствуют доменам комплементарного связывающего белка. [16]
Кадгерины — это кальцийзависимые молекулы адгезии. Кадгерины чрезвычайно важны в процессе морфогенеза — развития плода . Вместе с комплексом альфа-бета -катенина кадгерин может связываться с микрофиламентами цитоскелета клетки. Это обеспечивает гомофильную адгезию клетка-клетка. [17] Связанный комплекс β -катенин — α-катенин в адгезионных соединениях позволяет формировать динамическую связь с актиновым цитоскелетом. [18]
Интегрины действуют как адгезионные рецепторы, транспортируя сигналы через плазматическую мембрану в нескольких направлениях. Эти молекулы являются бесценной частью клеточной коммуникации, поскольку один лиганд может использоваться для многих интегринов. К сожалению, этим молекулам еще предстоит пройти долгий путь исследований. [19]
Суперсемейство иммуноглобулинов представляет собой группу кальций-независимых белков, способных к гомофильной и гетерофильной адгезии. Гомофильная адгезия включает иммуноглобулин-подобные домены на поверхности клетки, связывающиеся с иммуноглобулин-подобными доменами на поверхности противоположной клетки, тогда как гетерофильная адгезия относится к связыванию иммуноглобулин-подобных доменов с интегринами и углеводами. [20]
Клеточная адгезия является жизненно важным компонентом организма. Потеря этой адгезии влияет на структуру клеток, клеточные функции и связь с другими клетками и внеклеточным матриксом и может привести к серьезным проблемам со здоровьем и заболеваниям.
{{cite book}}: |journal=проигнорировано ( помощь )