Полимеразная цепная реакция в реальном времени ( ПЦР в реальном времени или кПЦР при количественном использовании) — лабораторный метод молекулярной биологии, основанный на полимеразной цепной реакции (ПЦР). Он отслеживает амплификацию целевой молекулы ДНК во время ПЦР (т. е. в реальном времени), а не в ее конце, как в обычной ПЦР. ПЦР в реальном времени может использоваться количественно и полуколичественно (т. е. выше/ниже определенного количества молекул ДНК).
Два распространенных метода обнаружения продуктов ПЦР в режиме реального времени — это (1) неспецифические флуоресцентные красители , которые интеркалируют с любой двухцепочечной ДНК, и (2) специфичные для последовательности ДНК-зонды, состоящие из олигонуклеотидов , помеченных флуоресцентным репортером, что позволяет проводить обнаружение только после гибридизации зонда с его комплементарной последовательностью.
В руководстве «Минимальная информация для публикации количественных экспериментов ПЦР в реальном времени» ( MIQE ) предлагается использовать аббревиатуру qPCR для количественной ПЦР в реальном времени, а RT-qPCR — для обратной транскрипции–qPCR. [1] Аббревиатура «RT-PCR» обычно обозначает полимеразную цепную реакцию с обратной транскрипцией , а не ПЦР в реальном времени, но не все авторы придерживаются этого соглашения. [2]

Клетки во всех организмах регулируют экспрессию генов путем оборота транскриптов генов (одноцепочечная РНК ): количество экспрессируемого гена в клетке можно измерить по количеству копий транскрипта РНК этого гена, присутствующего в образце. Для надежного обнаружения и количественной оценки экспрессии гена из небольших количеств РНК необходима амплификация транскрипта гена. Полимеразная цепная реакция (ПЦР) является распространенным методом амплификации ДНК; для ПЦР на основе РНК образец РНК сначала подвергается обратной транскрипции в комплементарную ДНК (кДНК) с помощью обратной транскриптазы .
Для амплификации небольших количеств ДНК используется та же методология, что и в обычной ПЦР с использованием ДНК-матрицы, по крайней мере одной пары специфических праймеров , дезоксирибонуклеотидтрифосфатов , подходящего буферного раствора и термостабильной ДНК-полимеразы . Вещество, помеченное флуорофором, добавляется к этой смеси в термоциклере , который содержит датчики для измерения флуоресценции флуорофора после его возбуждения на требуемой длине волны, что позволяет измерять скорость генерации для одного или нескольких конкретных продуктов. Это позволяет измерять скорость генерации амплифицированного продукта в каждом цикле ПЦР. Полученные таким образом данные можно анализировать с помощью компьютерного программного обеспечения для расчета относительной экспрессии гена (или числа копий мРНК ) в нескольких образцах. Количественная ПЦР также может применяться для обнаружения и количественной оценки ДНК в образцах, чтобы определить наличие и распространенность определенной последовательности ДНК в этих образцах. [3] Это измерение проводится после каждого цикла амплификации, и именно поэтому этот метод называется ПЦР в реальном времени (то есть немедленной или одновременной ПЦР).
Количественная ПЦР и ДНК-микрочипы являются современными методологиями для изучения экспрессии генов . Более старые методы использовались для измерения распространенности мРНК: дифференциальный дисплей , анализ защиты РНКазы и нозерн-блоттинг . Нозерн-блоттинг часто используется для оценки уровня экспрессии гена путем визуализации распространенности его транскрипта мРНК в образце. В этом методе очищенная РНК разделяется электрофорезом в агарозном геле , переносится на твердую матрицу (например, нейлоновую мембрану) и зондируется специфическим ДНК или РНК-зондом , который комплементарен интересующему гену. Хотя этот метод все еще используется для оценки экспрессии генов, он требует относительно больших количеств РНК и обеспечивает только качественную или полуколичественную информацию об уровнях мРНК. [4] Ошибки оценки, возникающие из-за изменений в методе количественной оценки, могут быть результатом целостности ДНК, эффективности фермента и многих других факторов. По этой причине был разработан ряд систем стандартизации (часто называемых методами нормализации ). Некоторые были разработаны для количественной оценки общей экспрессии генов, но наиболее распространенные направлены на количественную оценку конкретного изучаемого гена по отношению к другому гену, называемому нормализующим геном, который выбирается по его почти постоянному уровню экспрессии. Эти гены часто выбираются из генов домашнего хозяйства , поскольку их функции, связанные с основным клеточным выживанием, обычно подразумевают конститутивную экспрессию генов . [5] [6] Это позволяет исследователям сообщать соотношение для экспрессии интересующих генов, деленное на экспрессию выбранного нормализатора, тем самым позволяя сравнивать первый, фактически не зная его абсолютного уровня экспрессии.
Наиболее часто используемые нормализующие гены — это те, которые кодируют следующие молекулы: тубулин , глицеральдегид-3-фосфатдегидрогеназу , альбумин , циклофилин и рибосомальные РНК . [4]
ПЦР в реальном времени проводится в термоциклере, способном освещать каждый образец лучом света по крайней мере одной заданной длины волны и обнаруживать флуоресценцию, испускаемую возбужденным флуорофором . Термоциклер также способен быстро нагревать и охлаждать образцы, тем самым используя физико-химические свойства нуклеиновых кислот и ДНК-полимеразы .
Процесс ПЦР обычно состоит из серии температурных изменений, которые повторяются 25–50 раз. Эти циклы обычно состоят из трех этапов: первый, при температуре около 95 °C, позволяет разделить двойную цепь нуклеиновой кислоты; второй, при температуре около 50–60 °C, позволяет связать праймеры с ДНК-матрицей; [7] третий, при температуре от 68 до 72 °C, облегчает полимеризацию, осуществляемую ДНК-полимеразой. Из-за небольшого размера фрагментов последний этап обычно опускается в этом типе ПЦР, поскольку фермент способен реплицировать ампликон ДНК во время смены между этапом выравнивания и этапом денатурации. Кроме того, в четырехэтапной ПЦР флуоресценция измеряется во время коротких температурных фаз, длящихся всего несколько секунд в каждом цикле, при температуре, например, 80 °C, чтобы уменьшить сигнал, вызванный присутствием димеров праймеров при использовании неспецифического красителя. [8] Температуры и время, используемые для каждого цикла, зависят от множества параметров, таких как: фермент, используемый для синтеза ДНК, концентрация двухвалентных ионов и дезоксирибонуклеотидтрифосфатов (dNTP) в реакции и температура связывания праймеров. [9]
Методику ПЦР в реальном времени можно классифицировать по химическому составу, используемому для обнаружения продукта ПЦР, специфическим или неспецифическим флуорохромам.
ДНК-связывающий краситель связывается со всеми двухцепочечными (ds) ДНК в ПЦР, увеличивая квантовый выход флуоресценции красителя. Таким образом, увеличение продукта ДНК во время ПЦР приводит к увеличению интенсивности флуоресценции, измеряемой в каждом цикле. Однако красители dsDNA, такие как SYBR Green, будут связываться со всеми продуктами dsDNA PCR, включая неспецифические продукты PCR (такие как димер праймера ). Это может потенциально помешать или сделать невозможным точный мониторинг предполагаемой целевой последовательности.
В ПЦР в реальном времени с красителями dsDNA реакция готовится как обычно, с добавлением флуоресцентного красителя dsDNA. Затем реакция запускается в приборе для ПЦР в реальном времени , и после каждого цикла интенсивность флуоресценции измеряется детектором; краситель флуоресцирует только при связывании с dsDNA (т. е. продуктом ПЦР). Преимущество этого метода заключается в том, что для проведения амплификации требуется только пара праймеров, что снижает затраты; несколько целевых последовательностей можно отслеживать в пробирке, используя различные типы красителей.

Флуоресцентные репортерные зонды обнаруживают только ДНК, содержащую последовательность, комплементарную зонду; поэтому использование репортерного зонда значительно увеличивает специфичность и позволяет выполнять метод даже в присутствии другой dsDNA. Используя разноцветные метки, флуоресцентные зонды можно использовать в мультиплексных анализах для мониторинга нескольких целевых последовательностей в одной и той же пробирке. Специфичность флуоресцентных репортерных зондов также предотвращает помехи измерений, вызванные димерами праймеров , которые являются нежелательными потенциальными побочными продуктами в ПЦР. Однако флуоресцентные репортерные зонды не предотвращают ингибирующее действие димеров праймеров, которое может подавлять накопление желаемых продуктов в реакции.
Метод основан на зонде на основе ДНК с флуоресцентным репортером на одном конце и гасителем флуоресценции на противоположном конце зонда. Близкое расположение репортера к гасителю препятствует обнаружению его флуоресценции; разрушение зонда 5'-3' экзонуклеазной активностью полимеразы Taq нарушает близость репортера и гасителя и, таким образом, допускает негасимое излучение флуоресценции, которое может быть обнаружено после возбуждения лазером. Таким образом, увеличение продукта, на который нацелен репортерный зонд в каждом цикле ПЦР, вызывает пропорциональное увеличение флуоресценции из-за разрушения зонда и высвобождения репортера.

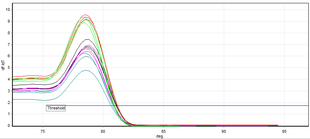
ПЦР в реальном времени позволяет идентифицировать специфические амплифицированные фрагменты ДНК с помощью анализа их температуры плавления (также называемой значением T m , от melting t emperature ). Обычно используемый метод — это ПЦР с двухцепочечными ДНК-связывающими красителями в качестве репортеров, а используемый краситель — обычно SYBR Green. Температура плавления ДНК специфична для амплифицированного фрагмента. Результаты этого метода получают путем сравнения кривых диссоциации анализируемых образцов ДНК. [11]
В отличие от обычной ПЦР, этот метод избегает предшествующего использования методов электрофореза для демонстрации результатов всех образцов. Это связано с тем, что, несмотря на то, что это кинетический метод, количественная ПЦР обычно оценивается в определенной конечной точке. Поэтому метод обычно обеспечивает более быстрые результаты и/или использует меньше реагентов, чем электрофорез. Если требуется последующий электрофорез, необходимо только проверить те образцы, которые ПЦР в реальном времени показала сомнительными, и/или подтвердить результаты для образцов, которые дали положительный результат на определенный детерминант.
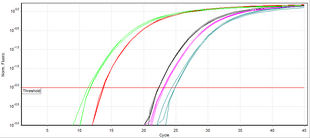
В отличие от ПЦР с конечной точкой (обычная ПЦР), ПЦР в реальном времени позволяет контролировать желаемый продукт в любой точке процесса амплификации путем измерения флуоресценции (в реальном времени измерение производится по ее уровню выше заданного порога). Обычно используемый метод количественной оценки ДНК с помощью ПЦР в реальном времени основан на построении графика флуоресценции против числа циклов в логарифмическом масштабе . Порог для обнаружения флуоресценции на основе ДНК устанавливается в 3–5 раз больше стандартного отклонения шума сигнала над фоном. Число циклов, при которых флуоресценция превышает порог, называется пороговым циклом (C t ) или, согласно рекомендациям MIQE, циклом количественной оценки (C q ) . [1]
Во время фазы экспоненциальной амплификации количество целевой ДНК-матрицы (ампликона) удваивается с каждым циклом. Например, образец ДНК, C q которого предшествует C q другого образца на 3 цикла, содержал в 2 3 = 8 раз больше матрицы. Однако эффективность амплификации часто варьируется среди праймеров и матриц. Поэтому эффективность комбинации праймер-матрица оценивается в эксперименте по титрованию с последовательными разведениями ДНК-матрицы для создания стандартной кривой изменения (C q ) с каждым разбавлением. Затем наклон линейной регрессии используется для определения эффективности амплификации, которая составляет 100%, если разбавление 1:2 приводит к разнице (C q ) 1. Метод порога цикла делает несколько предположений о механизме реакции и опирается на данные из областей с низким отношением сигнал-шум профиля амплификации, которые могут вносить существенную дисперсию во время анализа данных. [12]
Для количественной оценки экспрессии гена (C q ) для РНК или ДНК из интересующего гена вычитается из (C q ) РНК/ДНК из гена домашнего хозяйства в том же образце для нормализации вариации количества и качества РНК между различными образцами. Эта процедура нормализации обычно называется ΔC t -методом [13] и позволяет сравнивать экспрессию интересующего гена среди различных образцов. Однако для такого сравнения экспрессия нормализующего референтного гена должна быть очень схожей во всех образцах. Выбор референтного гена, отвечающего этому критерию, поэтому имеет большое значение и часто является сложной задачей, поскольку только очень немногие гены показывают одинаковые уровни экспрессии в диапазоне различных условий или тканей. [14] [15] Хотя анализ порогового цикла интегрирован со многими коммерческими программными системами, существуют более точные и надежные методы анализа данных профиля амплификации, которые следует учитывать в случаях, когда воспроизводимость является проблемой. [12]
Также были предложены методы количественной оценки ПЦР на основе механизмов, и их преимущество заключается в том, что они не требуют стандартной кривой для количественной оценки. Было показано, что такие методы, как MAK2 [16], имеют равную или лучшую количественную производительность по сравнению с методами стандартной кривой. Эти методы на основе механизмов используют знания о процессе амплификации полимеразы для получения оценок исходной концентрации образца. Расширение этого подхода включает точную модель всего профиля реакции ПЦР, что позволяет использовать данные с высоким отношением сигнал/шум и возможность проверки качества данных перед анализом. [12]
Согласно исследованию Ruijter et al. [17] MAK2 предполагает постоянную эффективность амплификации во время реакции ПЦР. Однако теоретический анализ полимеразной цепной реакции, из которой был получен MAK2, показал, что эффективность амплификации не является постоянной на протяжении всей ПЦР. В то время как количественное определение MAK2 обеспечивает надежные оценки целевой концентрации ДНК в образце при нормальных условиях qPCR, MAK2 не обеспечивает надежного количественного определения целевой концентрации для анализов qPCR с помощью компетиметров.
Существует множество применений количественной полимеразной цепной реакции в лаборатории . Она обычно используется как для диагностических , так и для фундаментальных исследований . Использование этой техники в промышленности включает в себя количественное определение микробной нагрузки в пищевых продуктах или на растительных материалах, обнаружение ГМО ( генетически модифицированных организмов ) и количественное определение и генотипирование вирусных патогенов человека.
Количественная оценка экспрессии генов традиционными методами обнаружения ДНК ненадежна. Обнаружение мРНК на нозерн-блоте или продуктов ПЦР на геле или саузерн-блоте не позволяет провести точную количественную оценку. [18] Например, за 20–40 циклов типичной ПЦР количество продукта ДНК достигает плато , которое напрямую не коррелирует с количеством целевой ДНК в исходной ПЦР. [19]
ПЦР в реальном времени может использоваться для количественной оценки нуклеиновых кислот двумя распространенными методами: относительной количественной оценкой и абсолютной количественной оценкой. [20] Абсолютная количественная оценка дает точное количество целевых молекул ДНК путем сравнения со стандартами ДНК с использованием калибровочной кривой . Поэтому важно, чтобы ПЦР образца и стандарта имели одинаковую эффективность амплификации . [21] Относительная количественная оценка основана на внутренних референтных генах для определения кратных различий в экспрессии целевого гена. Количественная оценка выражается как изменение уровней экспрессии мРНК, интерпретируемой как комплементарная ДНК (кДНК, полученная путем обратной транскрипции мРНК). Относительную количественную оценку легче проводить, поскольку она не требует калибровочной кривой, поскольку количество изучаемого гена сравнивается с количеством контрольного референтного гена.
Поскольку единицы, используемые для выражения результатов относительной количественной оценки, не важны, результаты можно сравнивать между несколькими различными ОТ-ПЦР. Причина использования одного или нескольких генов домашнего хозяйства заключается в исправлении неспецифических вариаций, таких как различия в количестве и качестве используемой РНК, которые могут повлиять на эффективность обратной транскрипции и, следовательно, на эффективность всего процесса ПЦР. Однако наиболее важным аспектом процесса является то, что референтный ген должен быть стабильным. [22]
Выбор этих референтных генов традиционно проводился в молекулярной биологии с использованием качественных или полуколичественных исследований, таких как визуальное исследование РНК-гелей, нозерн-блот -денситометрия или полуколичественная ПЦР (ПЦР-имитаторы). Теперь, в эпоху генома , можно провести более подробную оценку для многих организмов с использованием транскриптомных технологий . [23] Однако исследования показали, что амплификация большинства референтных генов, используемых для количественной оценки экспрессии мРНК, варьируется в зависимости от экспериментальных условий. [24] [25] [26] Поэтому необходимо провести начальное статистически обоснованное методологическое исследование, чтобы выбрать наиболее подходящий референтный ген.
Разработан ряд статистических алгоритмов, которые могут определить, какой ген или гены наиболее подходят для использования в данных условиях. Такие, как geNORM или BestKeeper, могут сравнивать пары или геометрические средние для матрицы различных референтных генов и тканей . [4] [6]
Диагностическая качественная ПЦР применяется для быстрого обнаружения нуклеиновых кислот , которые являются диагностическими для, например, инфекционных заболеваний , [27] [28] рака и генетических аномалий. Внедрение качественных ПЦР-анализов в клиническую микробиологическую лабораторию значительно улучшило диагностику инфекционных заболеваний, [29] и используется в качестве инструмента для обнаружения новых заболеваний, таких как новые штаммы гриппа и коронавируса , [30] в диагностических тестах . [31] [32]
Количественная ПЦР также используется микробиологами, работающими в области безопасности пищевых продуктов, порчи пищевых продуктов и ферментации, а также для оценки микробного риска качества воды (питьевой и рекреационной) и в сфере охраны общественного здоровья. [33]
qPCR также может использоваться для амплификации таксономических или функциональных маркеров генов в ДНК, взятой из образцов окружающей среды. [34] Маркеры представлены генетическими фрагментами ДНК или комплементарной ДНК. [34] Амплифицируя определенный генетический элемент, можно количественно определить количество элемента в образце до амплификации. [34] Использование таксономических маркеров (рибосомных генов) и qPCR может помочь определить количество микроорганизмов в образце и может идентифицировать различные семейства, роды или виды на основе специфичности маркера. [34] Использование функциональных маркеров (генов, кодирующих белок) может показать экспрессию генов в сообществе, что может раскрыть информацию об окружающей среде. [34]
Сельскохозяйственная промышленность постоянно стремится производить пропагулы растений или саженцы, свободные от патогенов, чтобы предотвратить экономические потери и защитить здоровье. Были разработаны системы, которые позволяют обнаруживать небольшие количества ДНК Phytophthora ramorum , оомицета, который убивает дубы и другие виды, смешанные с ДНК растения-хозяина. Различение ДНК патогена и растения основано на амплификации последовательностей ITS, спейсеров, расположенных в кодирующей области гена рибосомной РНК , которые характерны для каждого таксона. [35] Полевые версии этой техники также были разработаны для идентификации того же патогена. [36]
qPCR с обратной транскрипцией (RT-qPCR) может использоваться для обнаружения ГМО , учитывая его чувствительность и динамический диапазон при обнаружении ДНК. Альтернативы, такие как анализ ДНК или белка, обычно менее чувствительны. Используются специфические праймеры, которые амплифицируют не трансген, а промотор , терминатор или даже промежуточные последовательности, используемые в процессе конструирования вектора. Поскольку процесс создания трансгенного растения обычно приводит к вставке более чем одной копии трансгена, его количество также обычно оценивается. Это часто выполняется путем относительной количественной оценки с использованием контрольного гена из обработанного вида, который присутствует только в виде одной копии. [37] [38]
Вирусы могут присутствовать в организме человека из-за прямого заражения или коинфекций, что затрудняет диагностику с использованием классических методов и может привести к неправильному прогнозу и лечению. Использование ПЦР позволяет проводить как количественную оценку, так и генотипирование (характеристику штамма, проводимую с использованием кривых плавления) вируса, такого как вирус гепатита В. [39] Степень заражения, определяемая количественно как количество копий вирусного генома на единицу ткани пациента, имеет значение во многих случаях; например, вероятность того, что вирус простого герпеса 1 типа реактивируется, связана с числом инфицированных нейронов в ганглиях . [40] Эта количественная оценка проводится либо с обратной транскрипцией, либо без нее, как это происходит, если вирус интегрируется в геном человека в любой точке своего цикла, например, в случае ВПЧ (вируса папилломы человека), где некоторые из его вариантов связаны с появлением рака шейки матки . [41] ПЦР в реальном времени также позволила количественно определить цитомегаловирус человека (ЦМВ), который наблюдается у пациентов с иммунодефицитом после трансплантации солидных органов или костного мозга. [42]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )