
В химии силикат — это любой член семейства многоатомных анионов , состоящих из кремния и кислорода , обычно с общей формулой [SiO(4-2 х )−
4− х]
н, где 0 ≤ x < 2 . Семейство включает ортосиликат SiO.4-4( x = 0 ), метасиликат SiO2-3( x = 1 ) и пиросиликат Si 2 O6-7( Икс знак равно 0,5 , п знак равно 2 ). Это название также используется для любой соли таких анионов, например метасиликата натрия ; или любой сложный эфир , содержащий соответствующую химическую группу , например тетраметилортосиликат . [1] Название «силикат» иногда распространяется на любые анионы, содержащие кремний, даже если они не соответствуют общей формуле или содержат другие атомы, кроме кислорода; такие как гексафторосиликат [SiF 6 ] 2- . Чаще всего силикаты встречаются в виде силикатных минералов .
Для разнообразных производственных, технологических и художественных нужд силикаты являются универсальными материалами, как природными (такими как гранит , гравий и гранат ), так и искусственными (такими как портландцемент , керамика , стекло и жидкое стекло ).
В большинстве силикатов атом кремния занимает центр идеализированного тетраэдра , углами которого являются четыре атома кислорода, связанные с ним одинарными ковалентными связями по правилу октетов . [1] Атомы кислорода, несущие отрицательный заряд, связываются с другими катионами (M n+ ). Эта связь Si-OMO-Si является прочной и жесткой, свойства которой проявляются в камнеподобных силикатах. Силикаты можно классифицировать по длине и сшиванию силикатных анионов.
Изолированные ортосиликатные анионы имеют формулу SiO.4−
4. Распространенным минералом этой группы является оливин ( ( Mg ,Fe) 2SiO4 ).
Два или более атома кремния могут по-разному разделять атомы кислорода, образуя более сложные анионы, такие как пиросиликат Si .
2О6−
7.

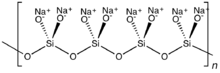
Если два общих оксида связаны с каждым кремнием, могут возникнуть циклические или полимерные структуры. Циклическое метасиликатное кольцо Si
6О12−
18представляет собой гексамер SiO 3 2- . Полимерные силикатные анионы могут существовать и в виде длинных цепочек.
В одноцепочечных силикатах, которые представляют собой разновидность иносиликата , тетраэдры соединяются в цепь, разделяя по два атома кислорода каждый. Распространенным минералом этой группы является пироксен .

Двухцепочечные силикаты, другая категория иносиликатов, возникают, когда тетраэдры образуют двойную цепь (не всегда, но в большинстве случаев), разделяя по два или три атома кислорода каждый. Обычными минералами этой группы являются амфиболы .

В этой группе, известной как слоистые силикаты , тетраэдры имеют по три атома кислорода каждый и, в свою очередь, соединяются, образуя двумерные листы. Эта структура действительно приводит к тому, что минералы этой группы имеют одну сильную плоскость спайности. Слюды попадают в эту группу. И мусковит , и биотит имеют очень слабые слои, которые можно отслаивать пластинками.
В каркасном силикате, известном как тектосиликат , каждый тетраэдр разделяет все 4 атома кислорода со своими соседями, образуя трехмерную структуру. К этой группе относятся кварц и полевые шпаты .
Хотя тетраэдр является обычной координационной геометрией для соединений кремния (IV), кремний также может встречаться с более высокими координационными числами. Например, в анионном гексафторосиликате SiF2−
6Атом кремния окружен шестью атомами фтора в октаэдрическом расположении. Эта структура также наблюдается в гексагидроксисиликатном анионе Si (OH)2−
6Это происходит в таумазите , минерале, редко встречающемся в природе, но иногда наблюдаемом среди других гидратов силиката кальция, искусственно образованных в цементных и бетонных конструкциях, подвергающихся сильному сульфатному воздействию в глинистых грунтах, содержащих окисленный пирит . [2] [3] [4] [5] [6]
При очень высоком давлении, которое существует в большей части земной коры, даже SiO 2 принимает шестикоординированную октаэдрическую геометрию в минерале стишовите , плотной полиморфной модификации кремнезема , обнаруженной в нижней мантии Земли и также образовавшейся в результате ударной волны во время удары метеорита .
Силикаты с катионами щелочных металлов и небольшими или цепочечными анионами, например орто- и метасиликат натрия , хорошо растворимы в воде. При кристаллизации из раствора они образуют несколько твердых гидратов . Растворимые силикаты натрия и их смеси, известные как жидкое стекло , на самом деле являются важными промышленными и бытовыми химикатами. Силикаты нещелочных катионов или с пластинчатыми и трехмерными полимерными анионами обычно имеют незначительную растворимость в воде при нормальных условиях.
Силикаты обычно химически инертны. Следовательно, они являются обычными минералами. Их устойчивость также позволяет использовать их в качестве строительных материалов.
При обработке оксидами кальция и водой силикатные минералы образуют портландцемент .
Равновесия, связанные с гидролизом силикатных минералов, трудно изучать. Главной проблемой является очень низкая растворимость SiO 4 4- и его различных протонированных форм. Такие равновесия имеют отношение к процессам, происходящим в геологических масштабах времени. [7] [8] Некоторые растения выделяют лиганды, которые растворяют силикаты, что является этапом биоминерализации .
Силикат-анионы в растворе реагируют с молибдат- анионами с образованием желтых силикомолибдатных комплексов. Было обнаружено , что при типичном приготовлении мономерный ортосиликат полностью реагирует за 75 секунд; димерный пиросиликат за 10 минут; и высшие олигомеры за значительно более длительное время. В частности, реакция не наблюдается с суспензиями коллоидного кремнезема . [8]
Природа растворимых силикатов важна для понимания биоминерализации и синтеза алюмосиликатов , таких как промышленно важные катализаторы , называемые цеолитами . [7] Наряду с алюминат- анионами , растворимые силикат-анионы также играют важную роль в механизме полимеризации геополимеров . Геополимеры — аморфные алюмосиликаты, для производства которых требуется меньше энергии, чем для производства обычного портландцемента . Таким образом, геополимерные цементы могут способствовать ограничению выбросов CO 2 в атмосферу Земли и глобального потепления, вызванного этим парниковым газом .