Кубан — это синтетическое углеводородное соединение с формулой C 8 H 8 . Он состоит из восьми атомов углерода, расположенных в углах куба , с одним атомом водорода, прикрепленным к каждому атому углерода. Твердое кристаллическое вещество, кубан является одним из платоновых углеводородов и членом призманов . Он был впервые синтезирован в 1964 году Филиппом Итоном и Томасом Коулом. [4] До этой работы Итон считал, что кубан будет невозможно синтезировать из-за «необходимых углов связи в 90 градусов ». [5] [6] Кубическая форма требует, чтобы атомы углерода принимали необычно острый угол связи в 90°, который был бы сильно напряжен по сравнению с углом 109,45 ° тетраэдрического углерода. После образования кубан довольно кинетически стабилен из-за отсутствия легкодоступных путей разложения. Это простейший углеводород с октаэдрической симметрией .
Высокая потенциальная энергия и кинетическая стабильность делают кубан и его производные соединения полезными для контролируемого хранения энергии. Например, октанитрокубан и гептанитрокубан изучались как высокоэффективные взрывчатые вещества. Эти соединения также обычно имеют очень высокую плотность для молекул углеводородов. Получающаяся в результате высокая плотность энергии означает, что большое количество энергии может храниться в сравнительно меньшем объеме пространства, что является важным соображением для применений в хранении топлива и транспортировке энергии. Кроме того, их геометрия и стабильность делают их подходящими изостерами для бензольных колец. [7]
Классический синтез 1964 года начинается с превращения 2-циклопентенона в 2- бромциклопентадиенон : [4] [8]
Аллильное бромирование N- бромсукцинимидом в четыреххлористом углероде с последующим добавлением молекулярного брома к алкену дает 2,3,4-трибромциклопентанон. Обработка этого соединения диэтиламином в диэтиловом эфире вызывает элиминацию двух эквивалентов бромистого водорода с получением диенового продукта.
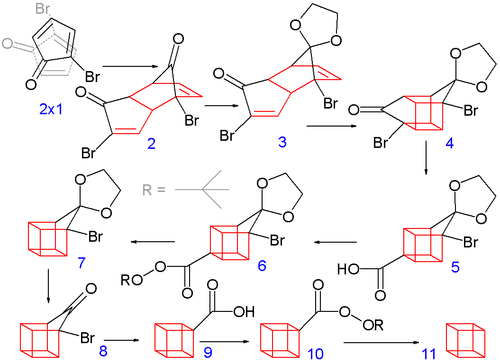
Построение восьмиуглеродного кубанового каркаса начинается, когда 2-бромциклопентадиенон подвергается спонтанной димеризации Дильса-Альдера . Один кеталь эндо- изомера затем селективно снимает защиту водной соляной кислотой до 3 .
На следующем этапе эндоизомер 3 (с обеими алкеновыми группами в непосредственной близости) образует изомер типа клетки 4 в фотохимическом [2+2] циклоприсоединении . Бромкетоновая группа преобразуется в сжатую в кольцо карбоновую кислоту 5 в перегруппировке Фаворского с гидроксидом калия . Затем происходит термическое декарбоксилирование через хлорангидрид (с тионилхлоридом ) и трет -бутилперэфир 6 (с трет-бутилгидропероксидом и пиридином ) до 7 ; затем ацеталь еще раз удаляется в 8. Вторая перегруппировка Фаворского дает 9 , и, наконец, еще одно декарбоксилирование дает, через 10 , кубан ( 11 ).
Более доступный лабораторный синтез дизамещенного кубана включает бромирование этиленового кеталя циклопентанона с получением производного трибромциклопентанона. Последующие шаги включают дегидробромирование, димеризацию Дильса-Альдера и т. д. [9] [10]

Полученная кубан-1,4-дикарбоновая кислота используется для синтеза других замещенных кубанов. Сам кубан может быть получен почти количественно фотохимическим декарбоксилированием тиогидроксаматного эфира ( декарбоксилирование Бартона ). [11]
Синтез производного октафенила из тетрафенилциклобутадиенового бромида никеля Фридманом в 1962 году предшествовал синтезу исходного соединения. Это труднорастворимое бесцветное соединение, плавящееся при температуре 425–427 °C. [3] [12] [13] [14] В публикации 2014 года было предсказано существование гиперкубана с гиперкубоподобной структурой. [ 15 ] [ 16] Были синтезированы два изомера кубена, а третий проанализирован с помощью вычислений . Алкен в орто -кубене исключительно реакционноспособен из-за своей пирамидальной геометрии . На момент его синтеза это был наиболее пирамидальный алкен из всех, что были получены. [17] Изомер мета -кубена еще менее стабилен, а изомер пара -кубена, вероятно, существует только как бирадикальная, а не фактическая диагональная связь. [18]
В 2022 году были синтезированы как гептафторкубан, так и октафторкубан . [19] Октафторкубан представляет теоретический интерес из-за своей необычной электронной структуры , [20] на которую указывает его восприимчивость к восстановлению до обнаруживаемого аниона C
8Ф−
8, со свободным электроном, запертым внутри куба, что фактически делает его самой маленькой коробкой в мире. [21]
Кубен (1,2-дегидрокубан) и 1,4-кубандиил (1,4-дегидрокубан) являются чрезвычайно напряженными соединениями, которые оба очень быстро подвергаются нуклеофильному присоединению , и это позволило химикам синтезировать кубилкубан. Решение структуры рентгеновской дифракции показало, что центральная связь кубилкубана чрезвычайно короткая (1,458 Å), намного короче типичной одинарной связи CC (1,578 Å). Это объясняется тем фактом, что экзоциклические орбитали кубана богаты s и близки к ядру. [22] Химики из Чикагского университета расширили и модифицировали последовательность таким образом, что это позволяет приготовить множество олигомеров [n]кубилкубана. [23] [n]кубилкубаны представляют собой жесткие молекулярные стержни с особыми перспективами на момент создания жидких кристаллов с исключительной прозрачностью в УФ-диапазоне. По мере увеличения числа связанных кубановых единиц растворимость [n]кубилкубана резко падает; в результате в растворах синтезирована только ограниченная длина цепи (до 40 единиц). Скелет [n]кубилкубанов по-прежнему состоит из чрезвычайно напряженных углеродных кубов, что ограничивает его стабильность. Напротив, исследователи из Университета штата Пенсильвания показали, что поликубан, синтезированный твердофазной реакцией, на 100% состоит из sp3 - углерода, связанного с тетраэдрическим углом (109,5°), и проявляет исключительные оптические свойства (высокий показатель преломления ). [24]
Кунеан может быть получен из кубана путем перегруппировки σ-связи, катализируемой ионами металла . [25] [26]
С родиевым катализатором сначала образуется син -трициклооктадиен, который может термически разлагаться до циклооктатетраена при температуре 50–60 °C. [27]
и кубан используются в общей номенклатуре и в качестве предпочтительных названий ИЮПАК.