Купраты — это класс соединений, которые содержат атом(ы) меди (Cu) в анионе . Их можно в целом разделить на два основных типа:
1. Неорганические купраты : эти соединения имеют общую формулу XYCu m O n . Некоторые из них нестехиометричны. Многие из этих соединений известны своими сверхпроводящими свойствами. [ необходима цитата ] Примером неорганического купрата является тетрахлорокупрат(II) или тетрахлорокупрат(II) ( [ Cu Cl 4 ] 2− ), анионный координационный комплекс , который включает атом меди в степени окисления +2, окруженный четырьмя хлорид -ионами.
2. Органические купраты : Это органомедные соединения, некоторые из которых имеют общую формулу [CuR 2 ] − , где медь находится в степени окисления +1, где по крайней мере одна из групп R может быть любой органической группой . Эти соединения, характеризующиеся медью, связанной с органическими группами, часто используются в органическом синтезе из-за их реакционной способности . [ необходима цитата ] Примером органического купрата является анион диметилкупрата(I) [Cu( CH 3 ) 2 ] − .
Одним из наиболее изученных купратов является Y Ba 2 Cu 3 O 7 , высокотемпературный сверхпроводящий материал . Этот оксидный купрат был предметом обширных исследований из-за его способности проводить электричество без сопротивления при относительно высоких температурах . [ требуется цитата ]
Одним из наименее изученных купратов является [Cu(CH 3 ) 2 ] − , высоконуклеофильный материал. Этот органический купрат наиболее известен своим участием в реакции электрофильного присоединения бензола Кормаса-Гризиуса , где он служит дополнительным нуклеофилом к высокоэлектрофильному бензольному кольцу, образованному посредством перегруппировки Маклафферти.
Термин «купрат» происходит от латинского слова «cuprum», обозначающего медь. Он в основном используется в контексте оксидных материалов, анионных координационных комплексов и анионных медноорганических соединений, отражая разнообразные роли меди в химии. Термин в основном используется в трех контекстах: оксидные материалы, анионные координационные комплексы и анионные медноорганические соединения. [ необходима цитата ]

Одним из простейших купратов на основе оксидов является купрат калия(III) KCuO 2 . Этот вид можно рассматривать как соль K + полианиона [CuO−2] n . Таким образом, материал классифицируется как оксид-купрат. Это темно-синее диамагнитное твердое вещество получается путем нагревания пероксида калия и оксида меди(II) в атмосфере кислорода : [1]
Известны и другие купраты(III) щелочных металлов ; кроме того, определено строение KCuO 2 ( купрата калия (III)), RbCuO 2 ( купрата рубидия (III)) и CsCuO 2 ( купрата цезия (III)). [2]
KCuO 2 был впервые открыт в 1952 году В.К. Валем и В. Клеммом, они синтезировали это соединение путем нагревания оксида меди (II) и надпероксида калия в атмосфере кислорода. [3]
Его также можно синтезировать путем нагревания супероксида калия и медного порошка: [4]
KCuO 2 реагирует с воздухом довольно медленно. Он начинает разлагаться при 760 К (487 °C; 908 °F), а его цвет меняется с синего на бледно-зеленый при 975 К (702 °C; 1295 °F). Его температура плавления составляет 1025 К (752 °C; 1385 °F). [3] [4]
RbCuO 2 (сине-черный) и CsCuO 2 (черный) могут быть получены путем реакции оксида рубидия и оксида цезия с порошками оксида меди(II) при 675 К (402 °C; 755 °F) и 655 К (382 °C; 719 °F) в атмосфере кислорода соответственно. Любой из них реагирует с воздухом быстро, в отличие от KCuO 2 . [4]
На самом деле KCuO 2 является нестехиометрическим соединением, поэтому более точная формула KCuO x , а x очень близок к 2. Это вызывает образование дефектов в кристаллической структуре , и это приводит к тенденции этого соединения к восстановлению . [4]
Купрат натрия (III) NaCuO 2 можно получить, используя гипохлориты или гипобромиты для окисления гидроксида меди в щелочных и низкотемпературных условиях. [5]
Купраты (III) нестабильны в воде и могут также окислять воду. [5]
Купрат натрия (III) имеет красновато-коричневый цвет, но постепенно чернеет по мере разложения до оксида меди (II) . [5] Чтобы предотвратить разложение, его необходимо готовить при низкой температуре в отсутствие света . [ требуется ссылка ]
Медь образует множество анионных координационных комплексов с отрицательно заряженными лигандами, такими как цианиды, гидроксиды и галогениды, а также алкилы и арилы.
Купраты, содержащие медь(I), как правило, бесцветны, что отражает их конфигурацию d 10 . Структуры варьируются от линейной 2-координатной , тригональной плоской и тетраэдрической молекулярной геометрии . Примеры включают линейную [Cu Cl 2 ] − и тригональную плоскую [CuCl 3 ] 2− . [6] Цианид дает аналогичные комплексы, но также и трианионный тетрацианокупрат(I), [Cu( CN ) 4 ] 3− . [7] Дицианокупрат(I), [Cu(CN) 2 ] − , существует как в молекулярных , так и в полимерных мотивах, в зависимости от противокатиона . [8]
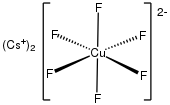
Купраты, содержащие медь(II), включают трихлорокупрат(II), [CuCl 3 ] − , который является димерным, и квадратно-плоский тетрахлорокупрат(II), [CuCl 4 ] 2− , и пентахлорокупрат(II), [CuCl 5 ] 3− . [9] [10] 3-координированные комплексы хлорокупрата(II) редки. [11]
Комплексы тетрахлорокупрата(II) имеют тенденцию принимать сплющенную тетраэдрическую геометрию с оранжевыми цветами. [12] [13] [14] [15]
Тетрагидроксикупрат(II) натрия ( Na 2 [Cu(OH) 4 ] ) является примером гомолептического ( все лиганды одинаковы) гидроксидного комплекса. [16]
Гексафторокупрат(III) [CuF 6 ] 3− и гексафторокупрат(IV) [CuF 6 ] 2− являются редкими примерами комплексов меди(III) и меди(IV). Они являются сильными окислителями .
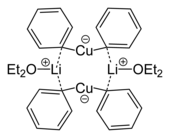
Купраты играют роль в органическом синтезе . Они неизменно являются Cu(I), хотя Cu(II) или даже Cu(III) промежуточные продукты используются в некоторых химических реакциях . Органические купраты часто имеют идеализированные формулы [CuR 2 ] − и [CuR 3 ] 2− , обе из которых содержат медь в степени окисления +1, где R представляет собой алкил или арил . Эти реагенты находят применение в качестве нуклеофильных алкилирующих реагентов . [18]