ДНК-лигаза — это тип фермента, который облегчает соединение цепей ДНК , катализируя образование фосфодиэфирной связи . Он играет роль в восстановлении одноцепочечных разрывов в дуплексной ДНК в живых организмах, но некоторые формы (например, ДНК-лигаза IV ) могут специально восстанавливать двухцепочечные разрывы (т. е. разрыв в обеих комплементарных цепях ДНК). Одноцепочечные разрывы восстанавливаются ДНК-лигазой с использованием комплементарной цепи двойной спирали в качестве матрицы [1] , при этом ДНК-лигаза создает конечную фосфодиэфирную связь для полного восстановления ДНК.
ДНК-лигаза используется как при репарации ДНК , так и при репликации ДНК (см. Лигазы млекопитающих ). Кроме того, ДНК-лигаза широко используется в лабораториях молекулярной биологии для экспериментов с рекомбинантной ДНК (см. Исследовательские применения ). Очищенная ДНК-лигаза используется при клонировании генов для соединения молекул ДНК вместе с образованием рекомбинантной ДНК .
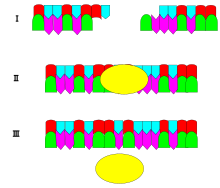
Механизм ДНК-лигазы заключается в образовании двух ковалентных фосфодиэфирных связей между 3'-гидроксильными концами одного нуклеотида («акцептор») и 5'-фосфатным концом другого («донор»). Для образования каждой фосфодиэфирной связи расходуются две молекулы АТФ. [ необходима цитата ] Для реакции лигазы, которая протекает в четыре этапа, требуется АМФ:
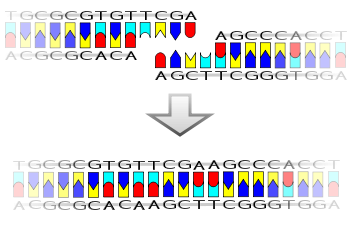
Лигаза также будет работать с тупыми концами , хотя для этого потребуются более высокие концентрации фермента и другие условия реакции.
ДНК-лигаза E. coli кодируется геном lig . ДНК-лигаза в E. coli , как и в большинстве прокариот, использует энергию, получаемую при расщеплении никотинамидадениндинуклеотида (НАД), для создания фосфодиэфирной связи. [3] Она не лигирует ДНК с тупыми концами, за исключением условий молекулярной скученности с полиэтиленгликолем , и не может эффективно соединять РНК с ДНК. [ требуется ссылка ]
Активность ДНК-лигазы E. coli может быть усилена ДНК-полимеразой при правильных концентрациях. Усиление работает только тогда, когда концентрации ДНК-полимеразы 1 намного ниже, чем фрагменты ДНК, которые нужно лигировать. Когда концентрации ДНК-полимераз Pol I выше, это оказывает неблагоприятное воздействие на ДНК-лигазу E. coli [4]
ДНК-лигаза из бактериофага T4 ( бактериофаг , который заражает бактерии Escherichia coli ). Лигаза T4 является наиболее часто используемой в лабораторных исследованиях. [5] Она может лигировать как липкие, так и тупые концы ДНК, олигонуклеотидов, а также РНК и гибридов РНК-ДНК, но не одноцепочечных нуклеиновых кислот. Она также может лигировать ДНК с тупыми концами с гораздо большей эффективностью, чем ДНК-лигаза E. coli . В отличие от ДНК-лигазы E. coli , ДНК-лигаза T4 не может использовать НАД и имеет абсолютную потребность в АТФ в качестве кофактора. Была проведена некоторая инженерия для улучшения активности ДНК-лигазы T4 in vitro ; Например, один успешный подход протестировал ДНК-лигазу T4, слитую с несколькими альтернативными ДНК-связывающими белками, и обнаружил, что конструкции с p50 или NF-kB в качестве партнеров слияния были более чем на 160% более активны в лигировании тупых концов для целей клонирования, чем ДНК-лигаза T4 дикого типа. [6] Типичная реакция для вставки фрагмента в плазмидный вектор будет использовать около 0,01 (липкие концы) до 1 (тупые концы) единиц лигазы. Оптимальная температура инкубации для ДНК-лигазы T4 составляет 16 °C. [ необходима цитата ]
Мутанты лигазы бактериофага Т4 обладают повышенной чувствительностью как к УФ- облучению [7] [8], так и к алкилирующему агенту метилметансульфонату [9], что указывает на то, что ДНК-лигаза участвует в восстановлении повреждений ДНК, вызванных этими агентами.
У млекопитающих существует четыре конкретных типа лигаз.
ДНК-лигаза эукариот и некоторых микробов использует аденозинтрифосфат (АТФ) вместо НАД. [3]
Полученный из термофильной бактерии, фермент стабилен и активен при гораздо более высоких температурах, чем обычные ДНК-лигазы. Его период полураспада составляет 48 часов при 65 °C и более 1 часа при 95 °C. Было показано, что ДНК-лигаза амплигразы активна в течение не менее 500 термических циклов (94 °C/80 °C) или 16 часов циклирования. 10 Эта исключительная термостабильность обеспечивает чрезвычайно высокую строгость гибридизации и специфичность лигирования. [11]
Для измерения активности ДНК-лигазы используются по крайней мере три различные единицы: [12]
ДНК-лигазы стали незаменимыми инструментами в современных исследованиях молекулярной биологии для создания рекомбинантных последовательностей ДНК. Например, ДНК-лигазы используются с ферментами рестрикции для вставки фрагментов ДНК, часто генов , в плазмиды .
Контроль оптимальной температуры является жизненно важным аспектом проведения эффективных экспериментов по рекомбинации, включающих лигирование фрагментов с когезионными концами. В большинстве экспериментов используется ДНК-лигаза T4 (выделенная из бактериофага T4 ), которая наиболее активна при 37 °C. [13] Однако для оптимальной эффективности лигирования с фрагментами с когезионными концами («липкие концы») оптимальная температура фермента должна быть сбалансирована с температурой плавления T m лигируемых липких концов, [14] гомологичное спаривание липких концов не будет стабильным, поскольку высокая температура нарушает водородные связи . Реакция лигирования наиболее эффективна, когда липкие концы уже стабильно отожжены, и нарушение отожженных концов, следовательно, приведет к низкой эффективности лигирования. Чем короче свес , тем ниже T m .
Поскольку у фрагментов ДНК с тупыми концами нет когезионно связанных концов для отжига, температура плавления не является фактором, который следует учитывать в пределах нормального температурного диапазона реакции лигирования. Ограничивающим фактором при лигировании с тупыми концами является не активность лигазы, а скорее количество выравниваний между концами фрагментов ДНК, которые происходят. Поэтому наиболее эффективной температурой лигирования для ДНК с тупыми концами будет температура, при которой может произойти наибольшее количество выравниваний. Большинство лигирований с тупыми концами проводятся при 14-25 °C в течение ночи. Отсутствие стабильно отожженных концов также означает, что эффективность лигирования снижается, что требует использования более высокой концентрации лигазы. [14]
Новое применение ДНК-лигазы можно увидеть в области нанохимии, в частности в ДНК-оригами. Принципы самосборки на основе ДНК оказались полезными для организации наномасштабных объектов, таких как биомолекулы, наномашины, наноэлектронные и фотонные компоненты. Сборка такой наноструктуры требует создания сложной сетки молекул ДНК. Хотя самосборка ДНК возможна без какой-либо внешней помощи с использованием различных субстратов, таких как предоставление кататонической поверхности алюминиевой фольги, ДНК-лигаза может обеспечить ферментативную помощь, которая требуется для создания решетчатой структуры ДНК из свисающих ДНК. [15]
Первая ДНК-лигаза была очищена и охарактеризована в 1967 году лабораториями Геллерта, Лемана, Ричардсона и Гурвица. [16] Впервые она была очищена и охарактеризована Вайсом и Ричардсоном с использованием шестиступенчатого процесса хроматографического фракционирования, начинающегося с удаления клеточного детрита и добавления стрептомицина, за которым следовали несколько промывок колонок диэтиламиноэтил (DEAE)-целлюлозой и окончательное фракционирование фосфоцеллюлозы. Конечный экстракт содержал 10% активности, первоначально зарегистрированной в среде E. coli ; в ходе процесса было обнаружено, что АТФ и Mg++ необходимы для оптимизации реакции. Обычные коммерчески доступные ДНК-лигазы были первоначально обнаружены в бактериофаге T4 , E. coli и других бактериях . [17]
Генетические дефекты ДНК-лигаз человека связаны с клиническими синдромами, отмеченными иммунодефицитом, чувствительностью к радиации и аномалиями развития, [16] Синдром LIG4 (синдром лигазы IV) является редким заболеванием, связанным с мутациями в ДНК-лигазе 4 и нарушающим механизмы репарации разрывов dsDNA. Синдром лигазы IV вызывает иммунодефицит у людей и обычно связан с микроцефалией и гипоплазией костного мозга. [18] Список распространенных заболеваний, вызванных отсутствием или неисправностью ДНК-лигазы, приведен ниже.
Пигментная ксеродерма , обычно известная как XP, является наследственным заболеванием, характеризующимся чрезвычайной чувствительностью к ультрафиолетовым (УФ) лучам солнечного света. Это заболевание в основном поражает глаза и участки кожи, подверженные воздействию солнца. У некоторых больных также наблюдаются проблемы с нервной системой. [19]
Мутации в гене ATM вызывают атаксию-телеангиэктазию . Ген ATM обеспечивает инструкции для создания белка, который помогает контролировать деление клеток и участвует в восстановлении ДНК. Этот белок играет важную роль в нормальном развитии и деятельности нескольких систем организма, включая нервную систему и иммунную систему. Белок ATM помогает клеткам распознавать поврежденные или разорванные нити ДНК и координирует восстановление ДНК, активируя ферменты, которые восстанавливают разорванные нити. Эффективное восстановление поврежденных нитей ДНК помогает поддерживать стабильность генетической информации клетки. У пораженных детей обычно возникают трудности с ходьбой, проблемы с равновесием и координацией рук, непроизвольные подергивания (хорея), мышечные подергивания (миоклонус) и нарушения нервной функции (невропатия). Проблемы с движением обычно приводят к тому, что к подростковому возрасту людям требуется помощь инвалидной коляски. Люди с этим расстройством также имеют невнятную речь и трудности с движением глаз, чтобы смотреть из стороны в сторону (окуломоторная апраксия). [20]
Анемия Фанкони (ФА) — редкое наследственное заболевание крови, которое приводит к недостаточности костного мозга. ФА не позволяет костному мозгу производить достаточно новых клеток крови для нормальной работы организма. ФА также может привести к тому, что костный мозг будет производить много дефектных клеток крови. Это может привести к серьезным проблемам со здоровьем, таким как лейкемия . [21]
Синдром Блума приводит к тому, что кожа становится чувствительной к воздействию солнца, и обычно к появлению пятен покрасневшей кожи в форме бабочки на носу и щеках. Кожная сыпь может также появляться на других участках, которые обычно подвергаются воздействию солнца, таких как тыльная сторона ладоней и предплечья. В сыпи часто появляются небольшие скопления расширенных кровеносных сосудов (телеангиэктазии); телеангиэктазии также могут возникать в глазах. Другие особенности кожи включают пятна кожи, которые светлее или темнее окружающих участков (гипопигментация или гиперпигментация соответственно). Эти пятна появляются на участках кожи, которые не подвергаются воздействию солнца, и их развитие не связано с высыпаниями.
В недавних исследованиях ДНК-лигаза I человека использовалась в компьютерном дизайне лекарств для идентификации ингибиторов ДНК-лигазы в качестве возможных терапевтических агентов для лечения рака. [22] Поскольку чрезмерный рост клеток является отличительной чертой развития рака, целевая химиотерапия, которая нарушает функционирование ДНК-лигазы, может препятствовать адъювантным формам рака. Кроме того, было показано, что ДНК-лигазы можно в целом разделить на две категории, а именно, АТФ- и НАД + -зависимые. Предыдущие исследования показали, что хотя НАД + -зависимые ДНК-лигазы были обнаружены в спорадических клеточных или вирусных нишах за пределами бактериального домена жизни, нет ни одного случая, когда НАД + -зависимая лигаза присутствовала бы в эукариотическом организме. Присутствие исключительно в неэукариотических организмах, уникальная субстратная специфичность и отличительная структура домена НАД + -зависимых по сравнению с АТФ-зависимыми ДНК-лигазами человека вместе делают НАД + -зависимые лигазы идеальными мишенями для разработки новых антибактериальных препаратов. [16]