
Кинетопласт — это сеть кольцевой ДНК (называемой кДНК) внутри митохондрии , которая содержит множество копий митохондриального генома . [1] [2] Наиболее распространенная структура кинетопласта — диск, но они наблюдались и в других расположениях. Кинетопласты встречаются только у Excavata класса Kinetoplastida . Различия в структурах кинетопластов могут отражать филогенетические связи между кинетопластидами. [3] Кинетопласт обычно примыкает к жгутиковому базальному тельцу организма , что позволяет предположить, что он связан с некоторыми компонентами цитоскелета . У Trypanosoma brucei это цитоскелетное соединение называется трехкомпонентным комплексом прикрепления и включает белок p166. [4]
У трипаносом , группы жгутиконосных простейших, кинетопласт существует в виде плотной гранулы ДНК внутри митохондрии. Trypanosoma brucei , паразит, вызывающий африканский трипаносомоз (африканскую сонную болезнь), является примером трипаносомы с кинетопластом. Ее кинетопласт легко увидеть в образцах, окрашенных DAPI , флуоресцентным красителем ДНК , или с помощью флуоресцентной гибридизации in situ (FISH) с BrdU, аналогом тимидина . [5]
Кинетопласт содержит кольцевую ДНК в двух формах: максикруги и миникруги . Максикруги имеют размер от 20 до 40 кб, и их несколько десятков на кинетопласт. На кинетопласт приходится несколько тысяч миникругов, и их размер составляет от 0,5 до 1 кб. Максикруги кодируют типичные белковые продукты, необходимые для митохондрий, которые зашифрованы. В этом заключается единственная известная функция миникругов — производство направляющей РНК (гРНК) для расшифровки этой зашифрованной информации максикруга, как правило, посредством вставки или удаления остатков уридина . Сеть максикругов и миникругов соединена , образуя плоскую сеть, которая напоминает кольчугу . Затем для воспроизведения этой сети требуется, чтобы эти кольца были отсоединены от родительского кинетопласта и впоследствии повторно соединены в дочернем кинетопласте. [5] [6] Этот уникальный способ репликации ДНК может вдохновить на создание потенциальных лекарственных мишеней .
Наиболее изученная структура кДНК принадлежит Crithidia fasciculata , представляющему собой сцепленный диск из кольцевых максикругов и миникругов кДНК, большинство из которых не являются суперспиральными . [3] Снаружи диска кДНК, но непосредственно рядом с ним, находятся два комплекса белков, расположенных под углом 180˚ друг к другу и участвующих в репликации миникругов. [1] [2] [5] [6]
Также наблюдались вариации сетей кинетопластов, которые описывались по расположению и расположению их кДНК.
Наличие этого разнообразия структур кДНК усиливает эволюционную связь между видами кинетопластид. Поскольку пан-кДНК наиболее близка к ДНК- плазмиде , она может быть предковой формой кДНК. [3]
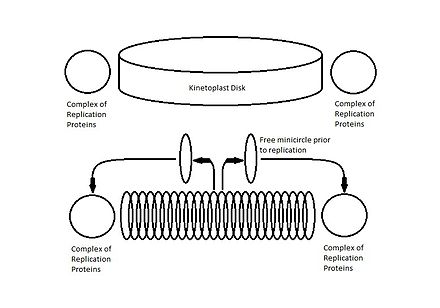
Репликация кинетопласта происходит одновременно с дупликацией соседнего жгутика и непосредственно перед репликацией ядерной ДНК . В традиционной сети кДНК Crithidia fasciculata инициация репликации стимулируется расцеплением миниколец кДНК с помощью топоизомеразы II . Свободные миниколец высвобождаются в область между кинетопластом и митохондриальной мембраной, называемую зоной кинетофлагеллярного типа (KFZ). [2] [3] [6] После репликации миниколец неизвестными механизмами мигрируют в антиподальные белковые комплексы, которые содержат несколько репликационных белков, включая эндонуклеазу , геликазу , ДНК -полимеразу , ДНК-праймазу и ДНК-лигазу , которые инициируют восстановление оставшихся разрывов в недавно реплицированных миниколец. [5]
Этот процесс происходит по одному миникольцу за раз, и только небольшое количество миниколец расцепляется в любой момент времени. Чтобы отслеживать, какие миникольца были реплицированы, при повторном присоединении к сети кДНК в зарождающихся миникольцах остается небольшой зазор, который идентифицирует их как уже реплицированные. Миникольца, которые еще не были реплицированы, все еще ковалентно замкнуты. Сразу после репликации каждое потомство прикрепляется к сети кДНК проксимально к антиподальным белковым комплексам, и зазоры частично восстанавливаются. [1] [6]


По мере того, как репликация мини-колец прогрессирует, чтобы предотвратить наращивание новых мини-колец, вся сеть кДНК будет вращаться вокруг центральной оси диска. Считается, что вращение напрямую связано с репликацией соседнего жгутика, поскольку дочернее базальное тельце также будет вращаться вокруг материнского базального тельца в соответствии с синхронизацией и способом, аналогичным вращению кинетопласта. При вращении мини-кольца дочернего кинетопласта собираются в спиральную форму и начинают двигаться внутрь к центру диска, поскольку новые мини-кольца расцепляются и перемещаются в KFZ для репликации. [2] [5] [6]
Хотя точные механизмы для максикольцевой кДНК еще предстоит определить в тех же деталях, что и для миникольцевой кДНК, наблюдается структура, называемая nabelschnur ( по -немецки « пуповина »), которая связывает дочерние сети кДНК, но в конечном итоге разрывается во время разделения. Используя зонды FISH для нацеливания на nabelschnur, было обнаружено, что он содержит максикольцевую кДНК. [5]
Репликация кинетопласта описывается как происходящая в пять стадий, каждая из которых связана с репликацией соседнего жгутика.
Trypanosoma cruzi способна восстанавливать нуклеотиды в своей геномной или кинетопластной ДНК , которые были повреждены активными формами кислорода, вырабатываемыми хозяином паразита во время инфекции. [7] ДНК-полимераза бета, экспрессируемая в T. cruzi , используется для удаления окислительных повреждений ДНК с помощью процесса репарации удаления оснований . Похоже, что ДНК-полимераза бета действует во время репликации ДНК кинетопласта , чтобы восстановить окислительные повреждения ДНК, вызванные генотоксическим стрессом в этой органелле. [7]