
Силикатом называется любой член семейства многоатомных анионов, состоящих из кремния и кислорода , обычно с общей формулой [SiO(4-2 х )−
4− х]
н, где 0 ≤ x < 2. Семейство включает ортосиликат SiO4−4( x = 0 ), метасиликат SiO2−3( x = 1 ) и пиросиликат Si 2 O6−7( x = 0,5 , n = 2 ). Название также используется для любой соли таких анионов, например, метасиликат натрия ; или любой эфир, содержащий соответствующую химическую группу , например, тетраметилортосиликат . [1] Название «силикат» иногда распространяется на любые анионы, содержащие кремний, даже если они не соответствуют общей формуле или содержат другие атомы, кроме кислорода; например, гексафторсиликат [SiF 6 ] 2− . Чаще всего силикаты встречаются в виде силикатных минералов .
Силикаты являются универсальными материалами для различных производственных, технологических и художественных нужд, как природными (например, гранит , гравий и гранат ), так и искусственными (например , портландцемент , керамика , стекло и жидкое стекло ).
В большинстве силикатов атом кремния занимает центр идеализированного тетраэдра , вершинами которого являются четыре атома кислорода, соединенные с ним одинарными ковалентными связями по правилу октета . [1] Атомы кислорода, несущие некоторый отрицательный заряд, связываются с другими катионами (M n+ ). Эта связь Si-OMO-Si является прочной и жесткой, свойства которой проявляются в силикатах, похожих на камни. Силикаты можно классифицировать по длине и сшивке силикатных анионов.
Изолированные ортосиликатные анионы имеют формулу SiO4−
4. Распространенным минералом в этой группе является оливин ( (Mg,Fe ) 2SiO4 ) .
Два или более атома кремния могут делить атомы кислорода различными способами, образуя более сложные анионы, такие как пиросиликат Si
2О6−
7.

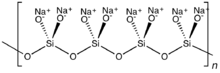
При наличии двух общих оксидов, связанных с каждым кремнием, могут возникнуть циклические или полимерные структуры. Циклическое метасиликатное кольцо Si
6О12−
18представляет собой гексамер SiO 3 2- . Полимерные силикатные анионы могут существовать также в виде длинных цепей.
В одноцепочечных силикатах, которые являются типом иносиликата , тетраэдры связываются, образуя цепь, разделяя два атома кислорода каждый. Распространенным минералом в этой группе является пироксен .

Двухцепочечные силикаты, другая категория иносиликатов, возникают, когда тетраэдры образуют двойную цепь (не всегда, но в основном), разделяя два или три атома кислорода каждый. Распространенными минералами для этой группы являются амфиболы .

В этой группе, известной как филлосиликаты , все тетраэдры делят по три атома кислорода и, в свою очередь, соединяются, образуя двумерные листы. Эта структура приводит к тому, что минералы в этой группе имеют одну сильную плоскость спайности. Слюды попадают в эту группу. И мусковит, и биотит имеют очень слабые слои, которые могут отслаиваться в листах.
В каркасном силикате, известном как тектосиликате , каждый тетраэдр делит все 4 атома кислорода со своими соседями, образуя трехмерную структуру. Кварц и полевые шпаты входят в эту группу.
Хотя тетраэдр является обычной геометрией координации для соединений кремния(IV), кремний может также встречаться с более высокими координационными числами. Например, в анионном гексафторосиликате SiF2−
6, атом кремния окружен шестью атомами фтора в октаэдрическом расположении. Такая структура также наблюдается в гексагидроксисиликатном анионе Si(OH)2−
6который встречается в таумасите , минерале, редко встречающемся в природе, но иногда наблюдаемом среди других гидратов силиката кальция, искусственно образованных в цементных и бетонных конструкциях, подвергающихся сильному воздействию сульфатов в глинистых грунтах, содержащих окисленный пирит . [2] [3] [4] [5] [6]
При очень высоком давлении, которое существует в большинстве пород Земли, даже SiO 2 принимает шестикоординированную октаэдрическую геометрию в минерале стишовите , плотном полиморфе кремнезема , обнаруженном в нижней мантии Земли и также образовавшемся в результате удара во время падения метеоритов .
Силикаты с щелочными катионами и небольшими или цепочечными анионами, такие как орто- и метасиликат натрия , довольно растворимы в воде. Они образуют несколько твердых гидратов при кристаллизации из раствора. Растворимые силикаты натрия и их смеси, известные как жидкое стекло , являются важными промышленными и бытовыми химикатами. Силикаты нещелочных катионов или с листовыми и трехмерными полимерными анионами, как правило, имеют незначительную растворимость в воде при нормальных условиях.
Силикаты, как правило, химически инертны. Поэтому они являются обычными минералами. Их устойчивость также позволяет использовать их в качестве строительных материалов.
При обработке оксидами кальция и водой силикатные минералы образуют портландцемент .
Равновесия, включающие гидролиз силикатных минералов, трудно изучать. Главной проблемой является очень низкая растворимость SiO 4 4- и его различных протонированных форм. Такие равновесия имеют отношение к процессам, происходящим в геологических масштабах времени. [7] [8] Некоторые растения выделяют лиганды, которые растворяют силикаты, что является шагом в биоминерализации .
Силикатные анионы в растворе реагируют с молибдатными анионами, образуя желтые силикомолибдатные комплексы. В типичном препарате было обнаружено, что мономерный ортосиликат полностью реагирует за 75 секунд; димерный пиросиликат за 10 минут; и более высокие олигомеры за значительно большее время. В частности, реакция не наблюдается с суспензиями коллоидного кремнезема . [8]
Природа растворимых силикатов важна для понимания биоминерализации и синтеза алюмосиликатов , таких как промышленно важные катализаторы, называемые цеолитами . [7] Наряду с анионами алюмината , растворимые анионы силикатов также играют важную роль в механизме полимеризации геополимеров . Геополимеры представляют собой аморфные алюмосиликаты, производство которых требует меньше энергии , чем производство обычного портландцемента . Таким образом, геополимерные цементы могут способствовать ограничению выбросов CO2 в атмосферу Земли и глобального потепления, вызванного этим парниковым газом .