
Митохондриальная генетика человека — это изучение генетики митохондриальной ДНК человека ( ДНК , содержащейся в митохондриях человека ). Митохондриальный геном человека — это совокупность наследственной информации, содержащейся в митохондриях человека. Митохондрии — это небольшие структуры в клетках , которые генерируют энергию для использования клеткой, и поэтому их называют «электростанциями» клетки.
Митохондриальная ДНК (мтДНК) не передается через ядерную ДНК (нДНК). У человека, как и у большинства многоклеточных организмов, митохондриальная ДНК наследуется только от материнской яйцеклетки . Однако существуют теории, что передача мтДНК по отцовской линии у человека может происходить при определенных обстоятельствах. [3] Таким образом, митохондриальная наследственность не является менделевской , поскольку менделевская наследственность предполагает, что половина генетического материала оплодотворенной яйцеклетки ( зиготы ) происходит от каждого родителя.
Это позволило создать гаплогруппы митохондриальной ДНК для изучения популяционной генетики .
Восемьдесят процентов митохондриальной ДНК кодируют митохондриальную РНК, и поэтому большинство мутаций митохондриальной ДНК приводят к функциональным проблемам, которые могут проявляться в виде мышечных расстройств ( миопатий ).
Поскольку митохондрии обеспечивают 30 молекул АТФ на молекулу глюкозы в отличие от 2 молекул АТФ, образующихся при гликолизе , митохондрии необходимы всем высшим организмам для поддержания жизни. Митохондриальные заболевания — это генетические нарушения, переносимые митохондриальной ДНК или ядерной ДНК, кодирующей митохондриальные компоненты. Небольшие проблемы с любым из многочисленных ферментов, используемых митохондриями, могут иметь разрушительные последствия для клетки и, в свою очередь, для организма.
У человека митохондриальная ДНК (мтДНК) образует замкнутые кольцевые молекулы, которые содержат 16 569 [4] [5] пар оснований ДНК , [6] причем каждая такая молекула обычно содержит полный набор митохондриальных генов. Каждая митохондрия человека содержит в среднем примерно 5 таких молекул мтДНК, количество которых колеблется от 1 до 15. [6] Каждая клетка человека содержит примерно 100 митохондрий, что дает общее количество молекул мтДНК на клетку человека примерно 500. [6] ] Количество митохондрий на клетку также варьируется в зависимости от типа клеток, вот некоторые примеры:
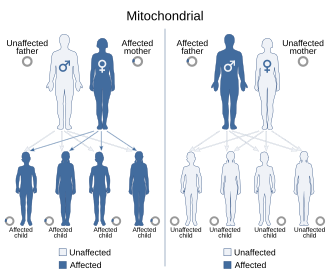

Поскольку митохондриальные заболевания (заболевания, возникающие вследствие нарушения работы митохондрий) могут наследоваться как по материнской линии, так и посредством хромосомного наследования, способ их передачи из поколения в поколение может сильно различаться в зависимости от заболевания. Митохондриальные генетические мутации, возникающие в ядерной ДНК, могут возникать в любой из хромосом (в зависимости от вида). Мутации, наследуемые через хромосомы, могут быть аутосомно-доминантными или рецессивными, а также могут быть сцепленными с полом доминантными или рецессивными. Хромосомная наследственность подчиняется обычным менделевским законам , несмотря на то, что фенотип заболевания может быть замаскирован.
Из-за сложных способов «коммуникации» и взаимодействия митохондриальной и ядерной ДНК трудно диагностировать даже, казалось бы, простое наследование. Мутация хромосомной ДНК может изменить белок, который регулирует (увеличивает или уменьшает) выработку другого определенного белка в митохондриях или цитоплазме; это может привести к легким, если таковые имеются, заметным симптомам. С другой стороны, некоторые разрушительные мутации мтДНК легко диагностировать из-за их широко распространенного повреждения мышечных, нервных и/или печеночных тканей (среди других высокоэнергетических и зависимых от метаболизма тканей), а также потому, что они присутствуют у матери и всех остальных тканей. потомство.
Число затронутых молекул мтДНК, унаследованных конкретным потомком, может сильно различаться, поскольку
Даже при рождении близнецов возможно, что один ребенок получит более половины мутантных молекул мтДНК, в то время как другой близнец может получить лишь небольшую часть мутантных молекул мтДНК по отношению к дикому типу (в зависимости от того, как близнецы делятся друг от друга и как по обе стороны деления оказывается множество мутантных митохондрий). В некоторых случаях некоторое количество митохондрий или митохондрии из сперматозоида попадают в ооцит, но отцовские митохондрии активно разлагаются.
Гены в митохондриальном геноме человека следующие.
Первоначально ошибочно считалось, что митохондриальный геном содержит только 13 белок-кодирующих генов, причем все они кодируют белки цепи переноса электронов . Однако в 2001 году был открыт 14-й биологически активный белок, названный гуманином , который кодируется митохондриальным геном MT-RNR2 , который также кодирует часть митохондриальной рибосомы (состоящей из РНК):
В отличие от других белков, гуманин не остается в митохондриях, а взаимодействует с остальной частью клетки и клеточными рецепторами. Гуманин может защищать клетки мозга, ингибируя апоптоз . Несмотря на название, версии гуманина существуют и у других животных, например, у крыс.
Следующие гены кодируют рРНК :
Следующие гены кодируют тРНК :
Митохондриальная ДНК традиционно имела две цепи ДНК, обозначаемые как тяжелая и легкая цепь, из-за их плавучей плотности во время разделения в градиентах хлорида цезия, [8] [9] , что, как было обнаружено, связано с относительным содержанием нуклеотидов G + T в прядь. [10] Однако путаница в маркировке этих цепей широко распространена и, по-видимому, возникла из-за того, что в одной влиятельной статье в 1999 году большая часть кодирующей цепи была идентифицирована как тяжелая. [11] [10] У людей легкая цепь мтДНК несет 28 генов, а тяжелая цепь мтДНК несет только 9 генов. [10] [12] Восемь из 9 генов тяжелой цепи кодируют молекулы митохондриальной тРНК. МтДНК человека состоит из 16 569 пар нуклеотидов. Вся молекула регулируется только одной регуляторной областью, которая содержит точки начала репликации как тяжелых, так и легких цепей. Полная молекула митохондриальной ДНК человека была картирована [1] [2] .
Генетический код по большей части универсален, за некоторыми исключениями: [13] митохондриальная генетика включает некоторые из них. Для большинства организмов « стоп-кодонами » являются «UAA», «UAG» и «UGA». В митохондриях позвоночных «AGA» и «AGG» также являются стоп-кодонами, но не «UGA», который вместо этого кодирует триптофан . «AUA» кодирует изолейцин у большинства организмов, но метионин в мРНК митохондрий позвоночных.
Существует множество других вариаций кодов, используемых другими митохондриальными м/тРНК, которые не оказались вредными для их организмов и которые можно использовать в качестве инструмента (наряду с другими мутациями среди мтДНК/РНК разных видов) для определения относительная близость общего происхождения родственных видов. (Чем более родственными являются два вида, тем больше мутаций мтДНК/РНК будет одинаковыми в их митохондриальном геноме).
Используя эти методы, было подсчитано, что первые митохондрии возникли около 1,5 миллиардов лет назад. Общепринятая гипотеза состоит в том, что митохондрии возникли из аэробных прокариот в симбиотических отношениях с анаэробными эукариотами .
Репликация митохондрий контролируется ядерными генами и специально приспособлена для создания такого количества митохондрий, сколько нужно конкретной клетке в данный момент.
Транскрипция митохондрий у человека инициируется тремя промоторами : H1, H2 и L (промоторы тяжелой цепи 1, тяжелой цепи 2 и промоторы легкой цепи). Промотор H2 транскрибирует почти всю тяжелую цепь, а промотор L — всю легкую цепь. Промотор H1 вызывает транскрипцию двух митохондриальных молекул рРНК. [14]
Когда транскрипция происходит на тяжелой цепи, создается полицистронный транскрипт. Легкая цепь производит либо небольшие транскрипты, которые можно использовать в качестве праймеров , либо один длинный транскрипт. Производство праймеров происходит путем обработки транскриптов легкой цепи с помощью митохондриальной РНКазы MRP (процессинг митохондриальной РНК). Необходимость транскрипции для производства праймеров связывает процесс транскрипции с репликацией мтДНК. Полноразмерные транскрипты разрезаются на функциональные молекулы тРНК, рРНК и мРНК. [ нужна цитата ]
В процессе инициации транскрипции в митохондриях участвуют три типа белков: митохондриальная РНК-полимераза ( POLRMT ), митохондриальный фактор транскрипции А (TFAM) и митохондриальные факторы транскрипции B1 и B2 (TFB1M, TFB2M). POLRMT , TFAM и TFB1M или TFB2M собираются на митохондриальных промоторах и начинают транскрипцию. Фактические молекулярные события, участвующие в инициации, неизвестны, но эти факторы составляют базальный механизм транскрипции и, как было показано, функционируют in vitro. [ нужна цитата ]
Митохондриальный перевод до сих пор не очень хорошо изучен. Трансляции in vitro до сих пор не увенчались успехом, вероятно, из-за сложности выделения достаточного количества мРНК, функциональной мРНК и, возможно, из-за сложных изменений, которые мРНК претерпевает перед трансляцией. [ нужна цитата ]
Митохондриальная ДНК-полимераза (Pol gamma, кодируемая геном POLG ) используется для копирования мтДНК во время репликации. Поскольку две цепи ( тяжелая и легкая ) кольцевой молекулы мтДНК имеют разные начала репликации , она реплицируется в режиме D-петли . Одна цепь начинает реплицироваться первой, вытесняя другую. Это продолжается до тех пор, пока репликация не достигнет начала репликации на другой цепи, после чего другая цепь начинает реплицироваться в противоположном направлении. В результате появляются две новые молекулы мтДНК. Каждая митохондрия имеет несколько копий молекулы мтДНК, и количество молекул мтДНК является ограничивающим фактором деления митохондрий . После того, как митохондрия наберет достаточно мтДНК, площади мембраны и мембранных белков, она может подвергнуться делению (очень похожему на то, которое используют бактерии), чтобы стать двумя митохондриями. Имеющиеся данные свидетельствуют о том, что митохондрии также могут подвергаться слиянию и обмену (в форме кроссовера ) генетическим материалом между собой. Митохондрии иногда образуют большие матрицы, в которых постоянно происходят слияние , деление и белковый обмен. мтДНК является общей для митохондрий (несмотря на то, что они могут подвергаться слиянию). [ нужна цитата ]
Митохондриальная ДНК подвержена повреждению свободными радикалами кислорода из-за ошибок, которые происходят во время производства АТФ через цепь переноса электронов. Эти ошибки могут быть вызваны генетическими нарушениями, раком и перепадами температур. Эти радикалы могут повредить молекулы мтДНК или изменить их, затрудняя их репликацию митохондриальной полимеразой. Оба случая могут привести к делециям, перестройкам и другим мутациям. Недавние данные свидетельствуют о том, что в митохондриях есть ферменты, которые считывают мтДНК и исправляют мутации, которые могут возникнуть из-за свободных радикалов. Считается, что ДНК-рекомбиназа, обнаруженная в клетках млекопитающих, также участвует в процессе репарационной рекомбинации. Делеции и мутации, вызванные свободными радикалами, связаны с процессом старения. Считается, что радикалы вызывают мутации, которые приводят к появлению мутантных белков, что, в свою очередь, приводит к увеличению количества радикалов. Этот процесс занимает много лет и связан с некоторыми процессами старения, затрагивающими кислородзависимые ткани, такие как мозг, сердце, мышцы и почки. Подобные процессы аутоусиления являются возможными причинами дегенеративных заболеваний, включая болезнь Паркинсона , болезнь Альцгеймера и ишемическую болезнь сердца . [ нужна цитата ]
Поскольку рост и деление митохондрий опосредованы ядерной ДНК, мутации в ядерной ДНК могут иметь широкий спектр эффектов на репликацию мтДНК. Несмотря на то, что локусы некоторых из этих мутаций были обнаружены в хромосомах человека, конкретные гены и белки, участвующие в этом процессе, еще не выделены. Для деления митохондриям необходим определенный белок. Если этого белка (генерируемого ядром) нет, митохондрии растут, но не делятся. Это приводит к образованию гигантских, неэффективных митохондрий. Ошибки в хромосомных генах или их продуктах также могут более непосредственно влиять на репликацию митохондрий, ингибируя митохондриальную полимеразу, и даже могут прямо или косвенно вызывать мутации в мтДНК. Косвенные мутации чаще всего вызываются радикалами, созданными дефектными белками, состоящими из ядерной ДНК. [ нужна цитата ]
Всего в митохондриях содержится около 3000 различных типов белков, но только около 13 из них кодируются митохондриальной ДНК. Большинство из 3000 типов белков участвуют в различных процессах, помимо производства АТФ, таких как синтез порфиринов . Лишь около 3% из них кодируют белки, вырабатывающие АТФ. Это означает, что большая часть генетической информации, кодирующей белковый состав митохондрий, находится в хромосомной ДНК и участвует в других процессах, помимо синтеза АТФ. Это увеличивает вероятность того, что мутация, которая затронет митохондрии, произойдет в хромосомной ДНК, которая наследуется по менделевскому типу. Другой результат заключается в том, что хромосомная мутация повлияет на конкретную ткань из-за ее особых потребностей, будь то высокие энергетические потребности или потребность в катаболизме или анаболизме определенного нейромедиатора или нуклеиновой кислоты. Поскольку каждая митохондрия несет несколько копий митохондриального генома (2–10 у человека), митохондриальные мутации могут передаваться по материнской линии за счет мутаций мтДНК, которые присутствуют в митохондриях внутри ооцита до оплодотворения, или (как указано выше) через мутации в хромосомы. [ нужна цитата ]
Митохондриальные заболевания варьируются по степени тяжести от бессимптомных до фатальных и чаще всего возникают из-за наследственных, а не приобретенных мутаций митохондриальной ДНК. Данная митохондриальная мутация может вызывать различные заболевания в зависимости от серьезности проблемы в митохондриях и ткани, в которой находятся пораженные митохондрии. И наоборот, несколько различных мутаций могут проявляться как одно и то же заболевание. Из-за такой почти индивидуальной характеристики митохондриальных заболеваний (см. Персонализированная медицина ) их очень сложно точно распознать, диагностировать и отследить. Некоторые заболевания наблюдаются при рождении или даже до него (многие из них приводят к смерти), тогда как другие не проявляются до позднего взросления (расстройства с поздним началом). Это связано с тем, что количество митохондрий мутантного и дикого типа варьируется в зависимости от клеток и тканей и постоянно меняется. Поскольку клетки имеют несколько митохондрий, разные митохондрии в одной и той же клетке могут иметь разные варианты мтДНК . Это состояние называется гетероплазмией . Когда в определенной ткани достигается определенное соотношение митохондрий мутантного и дикого типа, возникает заболевание. Соотношение варьируется от человека к человеку и от ткани к ткани (в зависимости от ее конкретных потребностей в энергии, кислороде и метаболизме, а также эффектов конкретной мутации). Митохондриальные заболевания очень многочисленны и разнообразны. Помимо заболеваний, вызванных аномалиями митохондриальной ДНК, предполагается, что многие заболевания частично связаны с митохондриальными дисфункциями, такими как сахарный диабет , [15] формы рака [16] и сердечно-сосудистые заболевания , лактацидоз , [17] специфические формы миопатия , [18] остеопороз , [19] болезнь Альцгеймера , [20] болезнь Паркинсона , [21] инсульт , [22] мужское бесплодие [23] и которые, как полагают, также играют роль в процессе старения . [24]
МтДНК человека также можно использовать для идентификации людей. [25] Судебно-медицинские лаборатории иногда используют сравнение мтДНК для идентификации человеческих останков, особенно для идентификации старых неопознанных останков скелетов. Хотя в отличие от ядерной ДНК мтДНК не специфична для одного человека, ее можно использовать в сочетании с другими доказательствами (антропологическими данными, косвенными доказательствами и т.п.) для установления идентификации. мтДНК также используется для исключения возможных совпадений между пропавшими без вести людьми и неопознанными останками. [26] Многие исследователи считают, что мтДНК лучше подходит для идентификации более старых останков скелета, чем ядерная ДНК, поскольку большее количество копий мтДНК на клетку увеличивает вероятность получения полезного образца, а также потому, что совпадение с живым родственником возможно даже если их разделяют многочисленные материнские поколения.
Останки американского преступника Джесси Джеймса были идентифицированы путем сравнения мтДНК, извлеченной из его останков, и мтДНК сына правнучки его сестры по женской линии. [27]
Точно так же останки Александры Федоровны (Аликс Гессенской) , последней императрицы России, и ее детей были идентифицированы путем сравнения их митохондриальной ДНК с ДНК принца Филиппа, герцога Эдинбургского , чья бабушка по материнской линии была сестрой Александры Викторией Гессенской . [28]
Аналогичным образом, для идентификации останков императора Николая II его митохондриальную ДНК сравнили с ДНК Джеймса Карнеги, 3-го герцога Файфского , чья прабабушка по материнской линии Александра Датская (королева Александра) была сестрой матери Николая II Дагмар Датской (императрица Мария Федоровна). [28] [29]
Аналогичным образом были идентифицированы останки короля Ричарда III . [30]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) {{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) {{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) {{cite journal}}: CS1 maint: неотмеченный бесплатный DOI ( ссылка )