
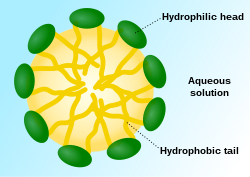
Мицелла ( / m aɪ ˈ s ɛ l / ) или мицелла ( / m aɪ ˈ s ɛ l ə / ) ( мн. ч. мицеллы или мицеллы соответственно ) представляет собой агрегат (или супрамолекулярную сборку ) поверхностно-активных амфипатических липидных молекул, диспергированных в жидкости, образующих коллоидную суспензию (также известную как ассоциированная коллоидная система). [4] Типичная мицелла в воде образует агрегат с гидрофильными «головными» областями, контактирующими с окружающим растворителем , изолируя гидрофобные однохвостые области в центре мицеллы.
Эта фаза вызвана поведением упаковки липидов с одним хвостом в бислое . Трудность заполнения объема внутренней части бислоя при размещении площади на головную группу, навязанной молекуле гидратацией головной группы липида, приводит к образованию мицеллы. Этот тип мицеллы известен как мицелла нормальной фазы (или мицелла типа «масло в воде»). Обратные мицеллы имеют головные группы в центре с выступающими хвостами (или мицелла типа «вода в масле»).
Мицеллы имеют приблизительно сферическую форму. Возможны также другие формы, такие как эллипсоиды, цилиндры и бислои. Форма и размер мицеллы зависят от молекулярной геометрии ее молекул поверхностно-активного вещества и условий раствора, таких как концентрация поверхностно-активного вещества, температура , pH и ионная сила . Процесс образования мицелл известен как мицеллизация и является частью фазового поведения многих липидов в соответствии с их полиморфизмом . [5]
Способность мыльного раствора действовать как моющее средство была признана на протяжении столетий. Однако только в начале двадцатого века состав таких растворов был научно изучен. Пионерская работа в этой области была проведена Джеймсом Уильямом МакБейном в Университете Бристоля . Еще в 1913 году он постулировал существование «коллоидных ионов», чтобы объяснить хорошую электролитическую проводимость растворов пальмитата натрия . [6] Эти высокоподвижные, спонтанно образующиеся кластеры стали называть мицеллами, термин заимствованный из биологии и популяризированный GS Hartley в его классической книге «Paraffin Chain Salts: A Study in Micelle Formation» . [7] Термин «мицелла» был придуман в научной литературе девятнадцатого века как уменьшительное от латинского слова mica (частица), передающее новое слово для «крошечной частицы». [8]
Отдельные молекулы поверхностно-активного вещества , которые находятся в системе, но не являются частью мицеллы, называются « мономерами ». Мицеллы представляют собой молекулярную сборку , в которой отдельные компоненты находятся в термодинамическом равновесии с мономерами того же вида в окружающей среде. В воде гидрофильные «головки» молекул поверхностно-активного вещества всегда находятся в контакте с растворителем, независимо от того, существуют ли поверхностно-активные вещества как мономеры или как часть мицеллы. Однако липофильные «хвосты» молекул поверхностно-активного вещества имеют меньший контакт с водой, когда они являются частью мицеллы — это является основой для энергетического движения к образованию мицелл. В мицелле гидрофобные хвосты нескольких молекул поверхностно-активного вещества собираются в маслоподобное ядро, наиболее стабильная форма которого не имеет контакта с водой. Напротив, мономеры поверхностно-активного вещества окружены молекулами воды, которые создают «клетку» или сольватную оболочку, соединенную водородными связями . Эта водная клетка похожа на клатрат и имеет льдоподобную кристаллическую структуру и может быть охарактеризована в соответствии с гидрофобным эффектом. Степень растворимости липидов определяется неблагоприятным энтропийным вкладом из-за упорядочения водной структуры в соответствии с гидрофобным эффектом .
Мицеллы, состоящие из ионных поверхностно-активных веществ, обладают электростатическим притяжением к окружающим их в растворе ионам, которые известны как противоионы . Хотя ближайшие противоионы частично маскируют заряженную мицеллу (до 92%), эффекты заряда мицеллы влияют на структуру окружающего растворителя на заметных расстояниях от мицеллы. Ионные мицеллы влияют на многие свойства смеси, включая ее электропроводность. Добавление солей к коллоиду, содержащему мицеллы, может уменьшить силу электростатических взаимодействий и привести к образованию более крупных ионных мицелл. [9] Это более точно видно с точки зрения эффективного заряда при гидратации системы.
Мицеллы образуются только тогда, когда концентрация поверхностно-активного вещества больше критической концентрации мицеллообразования (ККМ), а температура системы больше критической температуры мицеллообразования или температуры Крафта . Образование мицелл можно понять с помощью термодинамики : мицеллы могут образовываться спонтанно из-за баланса между энтропией и энтальпией . В воде гидрофобный эффект является движущей силой образования мицелл, несмотря на то, что сборка молекул поверхностно-активного вещества невыгодна как с точки зрения энтальпии, так и энтропии системы. При очень низких концентрациях поверхностно-активного вещества в растворе присутствуют только мономеры. По мере увеличения концентрации поверхностно-активного вещества достигается точка, в которой неблагоприятный вклад энтропии от кластеризации гидрофобных хвостов молекул перекрывается приростом энтропии из-за высвобождения сольватных оболочек вокруг хвостов поверхностно-активного вещества. В этот момент липидные хвосты части поверхностно-активных веществ должны быть отделены от воды. Следовательно, они начинают образовывать мицеллы. В общих чертах, выше ККМ потеря энтропии из-за сборки молекул поверхностно-активного вещества меньше, чем прирост энтропии за счет освобождения молекул воды, которые были «захвачены» в сольватных оболочках мономеров поверхностно-активного вещества. Также важны энтальпийные соображения, такие как электростатические взаимодействия, которые происходят между заряженными частями поверхностно-активных веществ.
Уравнение параметра упаковки мицелл используется для «предсказания молекулярной самосборки в растворах поверхностно-активных веществ»: [10]
где — объем хвоста поверхностно-активного вещества, — длина хвоста, — площадь равновесия на молекулу на поверхности агрегата.
Концепция мицелл была введена для описания агрегатов ядро-корона небольших молекул поверхностно-активных веществ , однако она также была расширена для описания агрегатов амфифильных блок-сополимеров в селективных растворителях. [11] [12] Важно знать разницу между этими двумя системами. Основное различие между этими двумя типами агрегатов заключается в размере их строительных блоков. Молекулы поверхностно-активных веществ имеют молекулярную массу , которая обычно составляет несколько сотен граммов на моль, в то время как блок-сополимеры обычно на один или два порядка больше. Более того, благодаря более крупным гидрофильным и гидрофобным частям блок-сополимеры могут иметь гораздо более выраженную амфифильную природу по сравнению с молекулами поверхностно-активных веществ.
Из-за этих различий в строительных блоках некоторые мицеллы блок-сополимеров ведут себя как поверхностно-активные вещества, а другие — нет. Поэтому необходимо различать эти две ситуации. Первые будут относиться к динамическим мицеллам , а вторые будут называться кинетически замороженными мицеллами.
Определенные мицеллы амфифильных блок-сополимеров демонстрируют поведение, похожее на поведение мицелл поверхностно-активного вещества. Их обычно называют динамическими мицеллами, и они характеризуются теми же релаксационными процессами, которые приписываются обмену поверхностно-активного вещества и расщеплению/рекомбинации мицелл. Хотя релаксационные процессы одинаковы для двух типов мицелл, кинетика обмена унимерами сильно различается. В то время как в системах поверхностно-активных веществ унимеры покидают мицеллы и присоединяются к ним посредством процесса, контролируемого диффузией , для сополимеров константа скорости входа медленнее, чем процесс, контролируемый диффузией. Было обнаружено, что скорость этого процесса представляет собой убывающую степенную зависимость степени полимеризации гидрофобного блока в степени 2/3. Это различие обусловлено скручиванием гидрофобного блока сополимера, выходящего из ядра мицеллы. [13]
Блок-сополимеры, которые при определенных условиях образуют динамические мицеллы, являются одними из трехблочных полоксамеров .
Когда блок-сополимерные мицеллы не демонстрируют характерные релаксационные процессы мицелл поверхностно-активных веществ, их называют кинетически замороженными мицеллами . Этого можно достичь двумя способами: когда унимеры, образующие мицеллы, не растворяются в растворителе раствора мицелл, или если блоки, образующие ядро, являются стеклообразными при температуре, при которой находятся мицеллы. Кинетически замороженные мицеллы образуются, когда выполняется любое из этих условий. Особым примером, в котором оба эти условия справедливы, является полистирол-b-поли(этиленоксид). Этот блок-сополимер характеризуется высокой гидрофобностью блока, образующего ядро, PS , что приводит к тому, что унимеры нерастворимы в воде. Более того, PS имеет высокую температуру стеклования , которая, в зависимости от молекулярной массы, выше комнатной температуры. Благодаря этим двум характеристикам водный раствор мицелл PS-PEO с достаточно высокой молекулярной массой можно считать кинетически замороженным. Это означает, что ни один из процессов релаксации, которые привели бы раствор мицелл к термодинамическому равновесию, невозможен. [14] Пионерская работа над этими мицеллами была проделана Ади Эйзенбергом. [15] Было также показано, как отсутствие процессов релаксации допускает большую свободу в возможных морфологиях образований. [16] [17] Более того, устойчивость к разбавлению и широкий диапазон морфологий кинетически замороженных мицелл делают их особенно интересными, например, для разработки наночастиц для доставки лекарств с большой продолжительностью циркуляции. [18]
В неполярном растворителе именно воздействие гидрофильных головных групп на окружающий растворитель энергетически невыгодно, что приводит к образованию системы вода-в-масле. В этом случае гидрофильные группы изолируются в ядре мицеллы, а гидрофобные группы распространяются от центра. Эти обратные мицеллы пропорционально менее склонны образовываться при увеличении заряда головной группы, поскольку гидрофильная изолировка создала бы крайне неблагоприятные электростатические взаимодействия.
Хорошо известно, что для многих систем поверхностно-активное вещество/растворитель небольшая часть обратных мицелл спонтанно приобретает чистый заряд +q e или -q e . Этот заряд происходит через механизм диспропорционирования/компропорционирования, а не через механизм диссоциации/ассоциации, и константа равновесия для этой реакции составляет порядка 10 −4 до 10 −11 , что означает, что примерно каждая 1 из 100 или 1 из 100 000 мицелл будет заряжена. [19]

Супермицелла представляет собой иерархическую структуру мицеллы ( супрамолекулярную сборку ), в которой отдельные компоненты также являются мицеллами. Супермицеллы образуются посредством химических подходов снизу вверх , таких как самосборка длинных цилиндрических мицелл в радиальные крестообразные, звездообразные или одуванчикообразные структуры в специально подобранном растворителе; твердые наночастицы могут быть добавлены в раствор, чтобы действовать как центры зародышеобразования и образовывать центральное ядро супермицеллы. Стебли первичных цилиндрических мицелл состоят из различных блок -сополимеров, соединенных прочными ковалентными связями ; внутри структуры супермицеллы они слабо удерживаются вместе водородными связями , электростатическими или сольвофобными взаимодействиями. [20] [21]
Когда поверхностно-активные вещества присутствуют выше критической концентрации мицеллообразования (ККМ), они могут действовать как эмульгаторы , которые позволят соединению, которое обычно нерастворимо (в используемом растворителе), раствориться. Это происходит потому, что нерастворимые виды могут быть включены в ядро мицеллы, которое само по себе растворяется в объеме растворителя в силу благоприятных взаимодействий головных групп с видами растворителя. Наиболее распространенным примером этого явления являются моющие средства , которые очищают плохо растворимые липофильные материалы (такие как масла и воски), которые не могут быть удалены только водой. Моющие средства очищают также за счет снижения поверхностного натяжения воды, что облегчает удаление материала с поверхности. Эмульгирующее свойство поверхностно-активных веществ также является основой для эмульсионной полимеризации .
Мицеллы также могут играть важную роль в химических реакциях. Мицеллярная химия использует внутреннюю часть мицелл для размещения химических реакций, что в некоторых случаях может сделать многоступенчатый химический синтез более осуществимым. [22] [23] Это может увеличить выход реакции, создать условия, более благоприятные для определенных продуктов реакции (например, гидрофобных молекул), и уменьшить требуемые растворители, побочные продукты и требуемые условия (например, экстремальный pH). Из-за этих преимуществ мицеллярная химия считается формой зеленой химии . [24] Однако образование мицелл может также ингибировать химические реакции, например, когда реагирующие молекулы образуют мицеллы, которые защищают молекулярный компонент, уязвимый для окисления. [25]
Использование катионных мицелл хлорида цетримония , хлорида бензетония и хлорида цетилпиридиния может ускорить химические реакции между отрицательно заряженными соединениями (такими как ДНК или кофермент А ) в водной среде до 5 миллионов раз. [26] В отличие от обычного мицеллярного катализа, [27] реакции происходят исключительно на поверхности заряженных мицелл.
Образование мицелл необходимо для всасывания жирорастворимых витаминов и сложных липидов в организме человека. Желчные соли, образующиеся в печени и секретируемые желчным пузырем, позволяют образовывать мицеллы жирных кислот. Это позволяет всасывать сложные липиды (например, лецитин) и жирорастворимые витамины (A, D, E и K) в мицелле тонким кишечником.
В процессе свертывания молока протеазы воздействуют на растворимую часть казеинов , κ-казеин , создавая нестабильное мицеллярное состояние, которое приводит к образованию сгустка.
Мицеллы также могут использоваться для целенаправленной доставки лекарств в виде золотых наночастиц. [28]