Электрохимическая ячейка — это устройство, которое генерирует электрическую энергию в результате химических реакций. Электрическая энергия также может быть подана к этим клеткам, чтобы вызвать химические реакции. [1] Электрохимические элементы, генерирующие электрический ток, называются гальваническими элементами , а те, которые генерируют химические реакции, например, посредством электролиза , называются электролитическими элементами . [2]
И гальванические, и электролитические элементы можно рассматривать как имеющие две полуячейки : состоящие из отдельных реакций окисления и восстановления.
Когда один или несколько электрохимических элементов соединены параллельно или последовательно, они образуют батарею . Первичные элементы представляют собой одноразовые батареи.
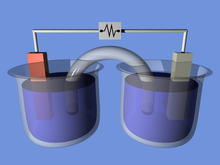
Гальванический элемент (вольтаический элемент), названный в честь Луиджи Гальвани ( Алессандро Вольта ) — электрохимический элемент, генерирующий электрическую энергию в результате спонтанных окислительно-восстановительных реакций. [3]

Провод соединяет два разных металла (например, цинк и медь). Каждый металл находится в отдельном растворе; часто водный сульфат или нитрат образует металл, однако чаще всего это соли металлов и вода, которые проводят ток. [4] Солевой мостик или пористая мембрана соединяют два раствора, сохраняя электрическую нейтральность и предотвращая накопление заряда. Различия в окислительно-восстановительном потенциале металлов приводят к реакции до достижения равновесия. [1]
Ключевая особенность:
Гальванические элементы состоят из двух полуэлементов. Каждая полуячейка состоит из электрода и электролита (в обеих полуячейках могут использоваться одинаковые или разные электролиты).
В химических реакциях в ячейке участвуют электролит, электроды и/или внешнее вещество ( в топливных элементах в качестве реагента может использоваться газообразный водород). В полной электрохимической ячейке частицы из одной полуячейки теряют электроны ( окисление ) на своем электроде, в то время как частицы из другой полуячейки получают электроны ( восстановление ) со своего электрода.
Солевой мостик (например, фильтровальная бумага, пропитанная KNO 3, NaCl или каким-либо другим электролитом) используется для ионного соединения двух полуэлементов с разными электролитами, но он предотвращает смешивание растворов и нежелательные побочные реакции. Альтернативой солевому мостику является обеспечение прямого контакта (и смешивания) между двумя полуэлементами, например, при простом электролизе воды .
Когда электроны перетекают из одной полуячейки в другую по внешней цепи, устанавливается разница в заряде. Если бы ионный контакт не был обеспечен, эта разница зарядов быстро препятствовала бы дальнейшему потоку электронов. Солевой мостик позволяет потоку отрицательных или положительных ионов поддерживать устойчивое распределение заряда между сосудами окисления и восстановления, сохраняя при этом содержимое отдельно. Другими устройствами для разделения растворов являются пористые горшки и гелеобразные растворы. В ячейке Бунзена используется пористый сосуд .
Каждая полуячейка имеет характеристическое напряжение (в зависимости от металла и его характерного восстановительного потенциала). В каждой реакции происходит равновесная реакция между различными степенями окисления ионов: когда равновесие достигнуто, ячейка не может обеспечивать дальнейшее напряжение. В полуячейке, осуществляющей окисление, чем ближе равновесие находится к иону/атому с более положительной степенью окисления, тем больший потенциал обеспечит эта реакция. [1] Аналогично, в реакции восстановления, чем ближе равновесие находится к иону/атому с более отрицательной степенью окисления, тем выше потенциал.
Потенциал ячейки можно предсказать с помощью электродных потенциалов (напряжений каждой полуячейки). Эти потенциалы полуэлементов определяются относительно напряжения 0 В на стандартном водородном электроде (SHE). (См. таблицу стандартных электродных потенциалов ). Разница в напряжении между потенциалами электродов дает прогноз измеренного потенциала. При расчете разницы напряжений необходимо сначала переписать уравнения реакции полуэлемента, чтобы получить сбалансированное уравнение окисления-восстановления.
Потенциалы ячеек имеют возможный диапазон примерно от нуля до 6 вольт. Элементы, использующие электролиты на водной основе, обычно ограничены потенциалом элемента менее 2,5 В из-за высокой реакционной способности мощных окислителей и восстановителей с водой, которая необходима для создания более высокого напряжения. Более высокие потенциалы клеток возможны, если клетки используют другие растворители вместо воды. Например, широко доступны литиевые элементы с напряжением 3 вольта.
Потенциал ячейки зависит от концентрации реагирующих веществ, а также от их типа. По мере того, как ячейка разряжается, концентрация реагентов уменьшается, а потенциал ячейки также уменьшается.
Электролитическая ячейка — это электрохимическая ячейка, в которой приложенная электрическая энергия вызывает несамопроизвольную окислительно-восстановительную реакцию. [5]

Их часто используют для разложения химических соединений в процессе, называемом электролизом . (Греческое слово «лиз» (λύσις) означает «потерять» или «освободить».)
Важными примерами электролиза являются разложение воды на водород и кислород , а также боксита на алюминий и другие химические вещества. Гальваническое покрытие (например, медью, серебром, никелем или хромом) выполняется с использованием электролизера. Электролиз – это метод, в котором используется постоянный электрический ток (DC).
Компонентами электролизера являются:
Под действием внешнего напряжения (разности потенциалов), приложенного к электродам, ионы в электролите притягиваются к электроду с противоположным потенциалом, где могут происходить реакции переноса заряда (также называемые фарадеевскими или окислительно-восстановительными реакциями). Только при достаточном внешнем напряжении электролитическая ячейка может разложить обычно стабильное или инертное химическое соединение в растворе. Таким образом, подаваемая электрическая энергия вызывает химическую реакцию, которая в противном случае не произошла бы самопроизвольно.
Ключевая особенность:

Первичный элемент производит ток в результате необратимых химических реакций (например, небольшие одноразовые батарейки) и не подлежит перезарядке.
Они используются из-за своей портативности, низкой стоимости и короткого срока службы.
Первичные элементы изготавливаются различных стандартных размеров для питания небольших бытовых приборов, таких как фонарики и портативные радиоприемники.
По мере того, как в первичном элементе происходят химические реакции, батарея расходует химические вещества, генерирующие энергию; когда они заканчиваются, батарея перестает вырабатывать электричество.
.jpg/440px-Diagram_of_a_primary_cell_(battery).jpg)
Первичные батареи составляют около 90% рынка аккумуляторов стоимостью 50 миллиардов долларов, но доля рынка вторичных батарей увеличивается. Ежегодно во всем мире выбрасывается около 15 миллиардов первичных батарей, [6] практически все они оказываются на свалках. Из-за содержащихся в них токсичных тяжелых металлов и сильных кислот или щелочей аккумуляторы являются опасными отходами . Большинство муниципалитетов классифицируют их как таковые и требуют отдельной утилизации. Энергия, необходимая для производства батареи, примерно в 50 раз превышает энергию, которую она содержит. [7] [8] [9] [10] Из-за высокого содержания загрязняющих веществ по сравнению с низким энергопотреблением первичные батареи считаются расточительной и экологически вредной технологией. В основном из-за увеличения продаж беспроводных устройств и беспроводных инструментов , которые не могут экономично питаться от первичных батарей и поставляются со встроенными перезаряжаемыми батареями, индустрия вторичных батарей имеет высокие темпы роста и постепенно заменяет первичные батареи в продуктах высокого класса.


Вторичный элемент производит ток в результате обратимых химических реакций (например, свинцово-кислотный автомобильный аккумулятор) и является перезаряжаемым.
Свинцово-кислотные аккумуляторы используются в автомобиле для запуска двигателя и работы электрооборудования автомобиля, когда двигатель не работает. Генератор переменного тока, когда автомобиль работает, заряжает аккумулятор.
Он может работать как гальванический элемент и электролитический элемент. Это удобный способ хранения электроэнергии: когда ток течет в одну сторону, уровни одного или нескольких химических веществ повышаются (заряжаются); пока он разряжается, они уменьшаются, и возникающая электродвижущая сила может совершить работу.
Они используются из-за высокого напряжения, низкой стоимости, надежности и длительного срока службы.

Топливный элемент — это электрохимический элемент, который реагирует с водородным топливом с кислородом или другим окислителем для преобразования химической энергии в электричество.
Топливные элементы отличаются от батарей тем, что для поддержания химической реакции требуется постоянный источник топлива и кислорода (обычно из воздуха), тогда как в батарее химическая энергия поступает из химических веществ, уже присутствующих в батарее.
Топливные элементы могут производить электроэнергию непрерывно до тех пор, пока подаются топливо и кислород.
Они используются для основного и резервного электроснабжения коммерческих, промышленных и жилых зданий, а также в отдаленных или труднодоступных районах. Они также используются для питания транспортных средств на топливных элементах , включая вилочные погрузчики, автомобили, автобусы, лодки, мотоциклы и подводные лодки.
Топливные элементы классифицируются по типу используемого электролита и разнице во времени запуска, которая колеблется от 1 секунды для топливных элементов с протонообменной мембраной (топливные элементы PEM, или PEMFC) до 10 минут для твердооксидных топливных элементов (ТОТЭ). .
Существует множество типов топливных элементов, но все они состоят из:
Родственной технологией являются проточные батареи , в которых топливо можно регенерировать путем перезарядки. Отдельные топливные элементы производят относительно небольшие электрические потенциалы, около 0,7 вольт, поэтому элементы «сложены» или размещены последовательно, чтобы создать достаточное напряжение для удовлетворения требований применения. [11] Помимо электроэнергии, топливные элементы производят воду, тепло и, в зависимости от источника топлива, очень небольшое количество диоксида азота и других выбросов. Энергоэффективность топливного элемента обычно составляет от 40 до 60% ; однако, если отходящее тепло улавливается в схеме когенерации , можно получить эффективность до 85%.
В 2022 году мировой рынок топливных элементов оценивался в 6,3 миллиарда долларов, и ожидается, что к 2030 году он увеличится на 19,9%. [12] Многие страны пытаются выйти на рынок, устанавливая цели по увеличению ГВт в области возобновляемых источников энергии . [13]
Производство одноразовой батареи требует примерно в 50 раз больше энергии, чем дает батарея при использовании.