- Мастигофорен А
- (–)- N -Ацетилаллоколхинол
Атропоизомеры — это стереоизомеры, возникающие из-за затрудненного вращения вокруг одинарной связи , где различия в энергии из-за стерического напряжения или других факторов создают барьер для вращения, который достаточно высок, чтобы обеспечить изоляцию отдельных конформеров . [1] [2] Они встречаются в природе и важны в фармацевтическом дизайне. [3] Когда заместители ахиральны, эти конформеры являются энантиомерами ( атропоэнантиомерами ), демонстрирующими аксиальную хиральность ; в противном случае они являются диастереомерами ( атроподиастереомерами ). [1]
Слово атропоизомер ( греч . ἄτροπος , atropos , означает «не превращаться») было придумано в приложении к теоретической концепции немецким биохимиком Рихардом Куном для основополагающего тома «Стереохимия» Карла Фрейденберга в 1933 году. [4] Атропоизомерия была впервые экспериментально обнаружена в тетразамещенном бифениле , дикислоте , Джорджем Кристи и Джеймсом Кеннером в 1922 году. [5] Мичинори Оки дополнительно уточнил определение атропоизомеров, приняв во внимание температурную зависимость, связанную с взаимопревращением конформеров, указав, что атропоизомеры взаимопревращаются с периодом полураспада не менее 1000 секунд при заданной температуре, что соответствует энергетическому барьеру 93 кДж моль −1 (22 ккал моль −1 ) при 300 К (27 °C). [6] [7]
Стабильность отдельных атропоизомеров обеспечивается отталкивающими взаимодействиями, которые ингибируют вращение. Вносят вклад как стерический объем, так и, в принципе, длина и жесткость связи, соединяющей две субъединицы. [1] [7] Обычно атропоизомерия изучается с помощью динамической ядерно-магнитной резонансной спектроскопии, поскольку атропоизомерия является формой флюксионности . [7] Выводы из теории и результаты результатов реакции и выходов также вносят вклад. [8]
Атропоизомеры проявляют аксиальную хиральность ( плоскую хиральность ). Когда барьер рацемизации высок, как показано на примере лигандов BINAP , явление приобретает практическую ценность в асимметричном синтезе. Метаквалон, анксиолитик и снотворно-седативный препарат, является классическим примером молекулы препарата, которая проявляет явление атропоизомерии. [9]

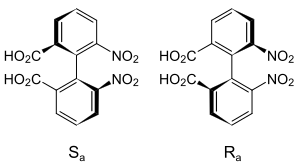
Определение аксиальной стереохимии биарильных атропоизомеров может быть достигнуто с помощью проекции Ньюмена вдоль оси затрудненного вращения. Орто- и в некоторых случаях мета- заместители первыми назначаются по приоритетным правилам Кана-Ингольда-Прелога . Одна схема номенклатуры основана на представлении спиральности, определяемой этими группами. [10] Начиная с заместителя с наивысшим приоритетом в ближайшем кольце и двигаясь по кратчайшему пути к заместителю с наивысшим приоритетом в другом кольце, абсолютная конфигурация назначается P или Δ для по часовой стрелке и M или Λ для против часовой стрелки. [1] Альтернативно, все четыре группы могут быть ранжированы по приоритетным правилам Кана-Ингольда-Прелога, при этом общий приоритет отдается двум группам на «переднем» атоме проекции Ньюмена. Две конфигурации, определенные таким образом, называются R a и S a , по аналогии с традиционным R / S для традиционного тетраэдрического стереоцентра. [11]

Аксиально хиральные биарильные соединения получают с помощью реакций сочетания, например, сочетания Ульмана , реакции Сузуки-Мияуры или катализируемого палладием арилирования аренов. [12] После синтеза рацемический биарил разделяют классическими методами. Диастереоселективное сочетание может быть достигнуто с помощью хирального мостика, который связывает две арильные группы, или с помощью хирального вспомогательного вещества в одном из положений, проксимальных к аксиальному мостику. Энантиоселективное сочетание может быть достигнуто с помощью хиральной уходящей группы на одном из биарилов или в окислительных условиях, которые используют хиральные амины для установки аксиальной конфигурации. [1]
Отдельные атропоизомеры могут быть выделены путем кристаллизации рацематов с использованием затравки. Таким образом, 1,1'-бинафтил кристаллизуется из расплава в виде отдельных энантиомеров. [13] [14] [15]



В одном из приложений асимметрия в атропоизомере переносится в химической реакции на новый стереоцентр . [16] Атропоизомер представляет собой иодоарильное соединение, синтезированное, начиная с (S) -валина , и существует в виде (M,S)-изомера и (P,S)-изомера. Барьер взаимопревращения между ними составляет 24,3 ккал / моль (101,7 кДж /моль). Изомер (M,S) может быть получен исключительно из этой смеси путем перекристаллизации из гексанов . Йодная группа гомолитически удаляется с образованием арильного радикала с помощью смеси трибутилоловогидрида /триэтилбора/кислорода, как в реакции Бартона-МакКомби . Хотя затрудненное вращение теперь удалено в арильном радикале, внутримолекулярная реакция с алкеном происходит настолько быстрее, чем вращение связи углерод-азот, что стереохимия сохраняется. Таким образом, (M,S)-изомер дает (S,S) -дигидроиндолон .
Наиболее важным классом атропоизомеров являются биарилы , такие как дифеновая кислота , которая является производным бифенила с полным набором орто- заместителей. Существуют также гетероароматические аналоги бифенильных соединений, где затрудненное вращение происходит вокруг связи углерод-азот или азот-азот. [7] Другие представляют собой димеры производных нафталина, такие как 1,1'-би-2-нафтол . Аналогичным образом, алифатические кольцевые системы, такие как циклогексаны, связанные через одинарную связь, могут проявлять атропоизомерию при условии, что присутствуют объемные заместители . Было обнаружено, что использование аксиально хиральных биарильных соединений, таких как BINAP , QUINAP и BINOL , полезно в области асимметричного катализа в качестве хиральных лигандов.
Их способность обеспечивать стереоиндукцию привела к использованию в реакциях гидрирования, эпоксидирования, присоединения и аллильного алкилирования, катализируемых металлами. [1] Другие реакции, которые могут быть катализированы с использованием хиральных биарильных соединений, - это реакция Гриньяра , реакция Ульмана и реакция Сузуки . [17] Недавний пример в области хирального биарильного асимметричного катализа использует пятичленный имидазол как часть атропоизомерного каркаса. Было показано, что этот специфический фосфор, азот-лиганд выполняет энантиоселективное A 3 -связывание. [18]
Многие атропоизомеры встречаются в природе, и некоторые из них применяются в разработке лекарств. [19] Было обнаружено, что натуральный продукт мастигофорен А способствует росту нервов. [1] [20] Другие примеры природных атропоизомеров включают ванкомицин, выделенный из Actinobacterium, и книфолон , который содержится в корнях Kniphofia foliosa семейства Asphodelaceae . Сложность структуры ванкомицина значительна, поскольку он может связываться с пептидами из-за сложности его стереохимии, которая включает несколько стереоцентров, две хиральные плоскости в его стереогенной биарильной оси. Книфолон, с его аксиальной хиральностью, встречается в природе и, как было показано, обладает хорошей противомалярийной и противоопухолевой активностью, особенно в форме М. [1]
Использование атропоизомерных препаратов дает дополнительный способ для препаратов иметь стереохимические вариации и специфичность в дизайне. [21] Одним из примеров является (–)- N -ацетилаллоколхинол, препарат, который, как было обнаружено, помогает в химиотерапевтическом лечении рака. [21] [22]
Телензепин является атропоизомером в конформации своего центрального тиенобензодиазепинового кольца. Были разрешены два энантиомера, и было обнаружено, что (+)-изомер, который примерно в 500 раз более активен, чем (–)-изомер в мускариновых рецепторах в коре головного мозга крыс. [23] Однако дизайн лекарств не всегда помогает атропоизомерии. В некоторых случаях создание лекарств из атропоизомеров является сложной задачей, поскольку изомеры могут взаимопревращаться быстрее, чем ожидалось. Атропоизомеры также могут по-разному взаимодействовать в организме, и, как и в случае с другими типами стереоизомеров , важно изучить эти свойства перед введением лекарств пациентам. [23]