
Влияние человека на азотный цикл разнообразно. В настоящее время поступления азота (N) в окружающую среду от сельского хозяйства и промышленности превышают поступления от естественной фиксации N. [1] В результате антропогенного воздействия глобальный азотный цикл (рис. 1) значительно изменился за последнее столетие. Глобальные мольные доли закиси азота (N 2 O) в атмосфере увеличились с доиндустриального значения ~270 нмоль/моль до ~319 нмоль/моль в 2005 году. [2] На деятельность человека приходится более трети выбросов N 2 O, большая часть которых приходится на сельскохозяйственный сектор. [2] Целью данной статьи является краткий обзор истории антропогенных поступлений N и сообщенных воздействий поступлений азота на отдельные наземные и водные экосистемы .
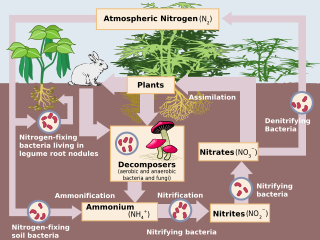
Приблизительно 78% атмосферы Земли составляет газ N (N 2 ), который является инертным соединением и биологически недоступен для большинства организмов. Для того, чтобы быть использованным в большинстве биологических процессов, N 2 должен быть преобразован в реактивный азот (Nr), который включает неорганические восстановленные формы (NH 3 и NH 4 + ), неорганические окисленные формы (NO, NO 2 , HNO 3 , N 2 O и NO 3 − ) и органические соединения ( мочевина , амины и белки ). [1] N 2 имеет сильную тройную связь, и поэтому для преобразования N 2 в Nr требуется значительное количество энергии (226 ккал моль −1 ) . [1] До появления промышленных процессов единственными источниками такой энергии были солнечное излучение и электрические разряды. [1] Используя большое количество метаболической энергии и фермент нитрогеназу , некоторые бактерии и цианобактерии преобразуют атмосферный N 2 в NH 3 , этот процесс известен как биологическая фиксация азота (БФН). [4] Антропогенным аналогом БФН является процесс Габера-Боша , в котором H 2 реагирует с атмосферным N 2 при высоких температурах и давлениях, образуя NH 3 . [5] Наконец, N 2 преобразуется в NO под действием энергии молнии , которая незначительна в современных умеренных экосистемах, или при сжигании ископаемого топлива . [1]
До 1850 года единственными источниками N для сельскохозяйственного производства были естественный BNF, BNF, индуцированный культивированием (например, посадка бобовых культур), и включенные органические вещества. [5] Ближе к рубежу веков Nr из гуано и залежей нитрата натрия собирали и экспортировали с засушливых островов Тихого океана и пустынь Южной Америки. [5] К концу 1920-х годов ранние промышленные процессы, хотя и неэффективные, широко использовались для производства NH 3 . [1] Благодаря усилиям Фрица Габера и Карла Боша , процесс Габера-Боша стал крупнейшим источником азотных удобрений после 1950-х годов и заменил BNF в качестве основного источника производства NH 3 . [5] С 1890 по 1990 год антропогенно созданный Nr увеличился почти в девять раз. [1] За это время население Земли увеличилось более чем втрое, отчасти из-за увеличения производства продуктов питания.
Со времен промышленной революции дополнительным источником антропогенного поступления N стало сжигание ископаемого топлива , которое используется для высвобождения энергии (например, для питания автомобилей). При сжигании ископаемого топлива высокие температуры и давления обеспечивают энергию для получения NO из окисления N 2. [1] Кроме того, когда ископаемое топливо добывается и сжигается, ископаемый N может стать реактивным (т. е. выбросы NO x ). [1] В 1970-х годах ученые начали осознавать, что поступления N накапливаются в окружающей среде и влияют на экосистемы. [1]
В период с 1600 по 1990 год глобальное создание реактивного азота (Nr) возросло почти на 50%. [6] В течение этого периода, как сообщается, выбросы видов Nr в атмосферу увеличились на 250%, а отложение в морских и наземных экосистемах увеличилось более чем на 200%. [6] Кроме того, было отмечено четырехкратное увеличение потоков растворенного неорганического N из рек к побережьям. [6] Азот является критическим ограничивающим питательным веществом во многих системах, включая леса, водно-болотные угодья, а также прибрежные и морские экосистемы; поэтому это изменение выбросов и распределения Nr привело к существенным последствиям для водных и наземных экосистем. [7] [8]
В атмосферные выбросы азота в основном входят оксиды азота (NO x ), аммиак (NH 3 ) и закись азота (N 2 O) из водных и наземных экосистем [4] , а также NO x от сжигания ископаемого топлива и биомассы [1] .
В агроэкосистемах применение удобрений увеличило микробную нитрификацию (аэробный процесс, в котором микроорганизмы окисляют аммоний [NH 4 + ] до нитрата [NO 3 − ]) и денитрификацию (анаэробный процесс, в котором микроорганизмы восстанавливают NO 3 − до атмосферного азотного газа [N 2 ]). Оба процесса естественным образом приводят к утечке оксида азота (NO) и закиси азота (N 2 O) в атмосферу. [4] Особую озабоченность вызывает N 2 O, средняя продолжительность жизни которого в атмосфере составляет 114–120 лет, [10] и который в 300 раз эффективнее CO 2 в качестве парникового газа . [4] NO x, производимый промышленными процессами, автомобилями и сельскохозяйственным удобрением, и NH 3, выбрасываемый из почв (т. е. как дополнительный побочный продукт нитрификации) [4] и животноводческой деятельности, переносятся в экосистемы с подветренной стороны, влияя на круговорот азота и потери питательных веществ. Было отмечено шесть основных последствий выбросов NO x и NH 3 : [1] 1) снижение видимости атмосферы из-за аэрозолей аммония (тонкодисперсные частицы [ТЧ]); 2) повышенная концентрация озона ; 3) озон и ТЧ влияют на здоровье человека (например, респираторные заболевания , рак ); 4) увеличение радиационного воздействия и глобальное изменение климата ; 5) снижение производительности сельского хозяйства из-за осаждения озона ; и 6) закисление экосистем [11] и эвтрофикация .
Наземные и водные экосистемы получают Nr из атмосферы через влажные и сухие отложения. [1] Атмосферные виды Nr могут осаждаться в экосистемах в виде осадков (например, NO 3 − , NH 4 + , органические соединения N), в виде газов (например, NH 3 и газообразная азотная кислота [HNO 3 ]) или в виде аэрозолей (например, нитрат аммония [NH 4 NO 3 ]). [1] Водные экосистемы получают дополнительный азот из поверхностного стока и речных стоков. [8]
Увеличение отложений N может подкислять почвы, ручьи и озера и изменить продуктивность лесов и пастбищ. В экосистемах пастбищ внесение N привело к первоначальному увеличению продуктивности, за которым последовало снижение по мере превышения критических порогов. [1] Также было продемонстрировано воздействие азота на биоразнообразие , круговорот углерода и изменения в составе видов . В высокоразвитых районах прибрежных океанических и эстуарных систем реки доставляют прямые (например, поверхностный сток ) и косвенные (например, загрязнение грунтовых вод) поступления N из агроэкосистем. [8] Увеличение внесения N может привести к закислению пресной воды и эвтрофикации морских вод.
Большая часть наземного роста в умеренных системах ограничена N; поэтому поступление N (т. е. через отложение и удобрение) может увеличить доступность N, что временно увеличивает поглощение N, рост растений и микроорганизмов, а также накопление N в биомассе растений и органическом веществе почвы . [12] Включение большего количества N в органическое вещество снижает соотношение C:N, увеличивая высвобождение минерального N (NH 4 + ) во время разложения органического вещества гетеротрофными микробами (т. е. аммонификация ). [13] По мере увеличения аммонификации увеличивается и нитрификация минерализованного N. Поскольку микробная нитрификация и денитрификация являются «протекающими», ожидается, что отложение N увеличит выбросы следовых газов. [14] Кроме того, с увеличением накопления NH 4 + в почве процессы нитрификации высвобождают ионы водорода, которые подкисляют почву. NO 3 − , продукт нитрификации, очень подвижен и может вымываться из почвы вместе с положительно заряженными щелочными минералами, такими как кальций и магний. [4] В кислых почвах мобилизованные ионы алюминия могут достигать токсичных концентраций, что отрицательно влияет как на наземные, так и на прилегающие водные экосистемы.
Антропогенные источники N обычно достигают горных лесов посредством отложения . [15] Потенциальной проблемой увеличения отложения N из-за деятельности человека является изменение круговорота питательных веществ в лесных экосистемах. Многочисленные исследования продемонстрировали как положительное, так и отрицательное влияние атмосферного отложения N на продуктивность лесов и хранение углерода. Добавленный N часто быстро иммобилизуется микробами , [ 16] а эффект оставшегося доступного N зависит от способности растительного сообщества усваивать N. [17] В системах с высоким поглощением N усваивается растительной биомассой, что приводит к повышению чистой первичной продуктивности (NPP) и, возможно, увеличению секвестрации углерода за счет большей фотосинтетической способности. Однако реакция экосистемы на внесение N зависит от многих специфичных для участка факторов, включая климат, историю землепользования и количество внесенного N. Например, на северо-востоке США насаждения лиственных пород, получающие хронические поступления N, продемонстрировали большую способность удерживать N и увеличивать годовую чистую первичную продуктивность (ANPP), чем насаждения хвойных пород. [18] Как только поступление N превышает потребность системы, N может быть утрачен через выщелачивание и газовые потоки. Когда доступный N превышает способность экосистемы (т. е. растительности, почвы, микробов и т. д.) поглощать, происходит насыщение N , и избыток N теряется в поверхностных водах, грунтовых водах и атмосфере. [12] [17] [18] Насыщение N может привести к дисбалансу питательных веществ (например, потере кальция из-за выщелачивания нитрата) и возможному вымиранию лесов. [13]
15-летнее исследование хронических добавок N в рамках программы долгосрочных экологических исследований Гарвардского университета ( LTER ) выявило множество последствий повышенного отложения азота на круговорот питательных веществ в лесах умеренного пояса. Было обнаружено, что хронические добавки N привели к большим потерям от выщелачивания, увеличению смертности сосен и прекращению накопления биомассы. [18] Другое исследование сообщило, что хронические добавки N привели к накоплению нефотосинтетического N и, следовательно, снижению фотосинтетической способности, что предположительно привело к серьезному углеродному стрессу и смертности. [17] Эти результаты опровергают предыдущие гипотезы о том, что повышенные поступления N увеличат NPP и секвестрацию углерода .
Многие растительные сообщества развивались в условиях низкого содержания питательных веществ; поэтому увеличение поступления N может изменить биотические и абиотические взаимодействия, что приводит к изменениям в составе сообщества. Несколько исследований по добавлению питательных веществ показали, что увеличение поступления N приводит к доминированию быстрорастущих видов растений с соответствующим снижением видового богатства. [19] [20] [21] Быстрорастущие виды имеют большее сродство к поглощению азота и вытесняют медленнорастущие виды растений, блокируя доступ к солнечному свету своей более высокой надземной биомассой. [22] Другие исследования показали, что вторичные реакции системы на обогащение N, включая подкисление почвы и изменения в микоризных сообществах, позволили стрессоустойчивым видам вытеснить чувствительные виды. [11] [23] Деревья, имеющие арбускулярные микоризные ассоциации, с большей вероятностью получат выгоду от увеличения содержания почвенного азота, поскольку эти грибы не способны расщеплять органический азот почвы. [24] Два других исследования обнаружили доказательства того, что повышенная доступность N привела к снижению разнообразия видов пустошей . Пустоши характеризуются почвами, бедными N, что исключает травы, требующие N; однако с увеличением отложения N и подкислением почвы , вторгающиеся луга заменяют низинные пустоши. [25] [26]
В более позднем экспериментальном исследовании удобрения азотом и нарушения (т. е. обработки почвы) в старой полевой сукцессии было обнаружено, что видовое богатство уменьшалось с увеличением азота, независимо от уровня нарушения. Эксперименты по конкуренции показали, что конкурентные доминанты исключали конкурентно слабые виды между событиями нарушения. С увеличением поступления азота конкуренция смещалась с подземных на надземные (т. е. к конкуренции за свет), и темпы колонизации участков значительно снижались. Эти внутренние изменения могут существенно влиять на сообщество, сдвигая баланс компромиссов конкуренции-колонизации между видами. [21] В системах, основанных на участках, региональное сосуществование может происходить посредством компромиссов в конкурентных и колонизирующих способностях при достаточно высоких уровнях нарушения. [27] То есть, при обратном ранжировании конкурентных и колонизирующих способностей растения могут сосуществовать в пространстве и времени, поскольку нарушение удаляет превосходных конкурентов с участков, позволяя устанавливать превосходных колонизаторов. Однако, как продемонстрировали Уилсон и Тилман, увеличение поступления питательных веществ может свести на нет компромиссы, что приводит к конкурентному исключению этих превосходных колонизаторов/плохих конкурентов. [21]
Водные экосистемы также демонстрируют различные реакции на обогащение азотом. NO 3 − нагрузка от насыщенных N наземных экосистем может привести к закислению пресноводных систем ниже по течению и эвтрофикации морских систем ниже по течению. Закисление пресной воды может вызвать токсичность алюминия и гибель видов рыб, чувствительных к pH. Поскольку морские системы, как правило, ограничены азотом, чрезмерное поступление N может привести к ухудшению качества воды из-за токсичного цветения водорослей, дефицита кислорода, потери среды обитания, снижения биоразнообразия и потерь в рыбном хозяйстве. [8]
Атмосферное осаждение N в наземных ландшафтах может быть преобразовано посредством микробных процессов в почве в биологически доступный азот, что может привести к закислению поверхностных вод и потере биоразнообразия . Поступления NO 3 − и NH 4 + из наземных систем и атмосферы могут закислять пресноводные системы, когда буферная емкость мала из-за закисления почвы . [8] Загрязнение N в Европе, северо-востоке США и Азии является актуальной проблемой закисления пресной воды . [28] Исследования закисления озер в Экспериментальной озерной зоне (ELA) на северо-западе Онтарио ясно продемонстрировали негативное влияние повышенной кислотности на местные виды рыб: популяция и рост озерной форели (Salvelinus namaycush) резко сократились из-за истребления ее основных видов добычи во время закисления. [29] Реактивный азот из сельского хозяйства, животноводства, удобрений, септических систем и других источников повысил концентрацию нитратов в водных путях большинства промышленно развитых стран. Концентрация нитратов в 1000 норвежских озерах удвоилась менее чем за десятилетие. Реки на северо-востоке США и в большинстве стран Европы увеличились в десять-пятнадцать раз за последнее столетие. Реактивный азот может загрязнять питьевую воду через сток в ручьи, озера, реки и грунтовые воды. Только в Соединенных Штатах около 20% источников грунтовых вод превышают предел Всемирной организации здравоохранения по концентрации нитратов в питьевой воде. Эти высокие концентрации могут вызвать «синюшную болезнь младенцев», когда ионы нитрата ослабляют способность крови переносить кислород. Исследования также связывают высокие концентрации нитратов с репродуктивными проблемами и склонностью к некоторым видам рака, таким как рак мочевого пузыря и яичников. [30]
Урбанизация, вырубка лесов и сельскохозяйственная деятельность в значительной степени способствуют поступлению осадка и питательных веществ в прибрежные воды через реки. [8] Увеличение поступления питательных веществ в морские системы показало как краткосрочное увеличение производительности и урожаев рыбы, так и долгосрочные пагубные последствия эвтрофикации . Утроение нагрузки NO 3 - в реке Миссисипи во второй половине 20-го века было связано с увеличением урожаев рыбы в водах, окружающих дельту Миссисипи; [31] однако, эти поступления питательных веществ вызвали сезонную гипоксию (концентрация кислорода менее 2–3 мг л -1 , « мертвые зоны ») в Мексиканском заливе . [1] [8] В эстуарных и прибрежных системах высокие поступления питательных веществ увеличивают первичную продукцию (например, фитопланктон , морские травы, макроводоросли), что увеличивает мутность , что приводит к снижению проникновения света по всей толще воды. Следовательно, рост подводной растительности снижается, что снижает сложность среды обитания и выработку кислорода. Увеличение первичной продукции (т. е. фитопланктона, макроводорослей и т. д.) приводит к потоку углерода в придонные воды, когда разлагающееся органическое вещество (т. е. стареющая первичная продукция) опускается и потребляется аэробными бактериями ниже в толще воды. В результате потребление кислорода в придонных водах больше, чем диффузия кислорода из поверхностных вод. Кроме того, определенное цветение водорослей, называемое вредоносным цветением водорослей (ВЦВ), вырабатывает токсины, которые могут действовать как нейромышечные или повреждающие органы соединения. Это цветение водорослей может быть вредным для других морских животных, а также для людей. [32] [33]
Вышеуказанные системные реакции на поступления реактивного азота (Nr) почти все изучаются исключительно по отдельности; однако исследования все больше указывают на то, что проблемы загрузки азота связаны несколькими путями, транспортирующими питательные вещества через границы системы. [1] Этот последовательный перенос между экосистемами называется каскадом азота. [6] (см. иллюстрацию из Программы ООН по окружающей среде). Во время каскада некоторые системы накапливают Nr, что приводит к временной задержке в каскаде и усилению воздействия Nr на окружающую среду, в которой он накапливается. В конечном счете, антропогенные поступления Nr либо накапливаются, либо денитрифицируются; однако, был достигнут небольшой прогресс в определении относительной важности накопления и денитрификации Nr , что в основном было связано с отсутствием интеграции между научными дисциплинами. [1] [34]
Большая часть Nr, применяемого в глобальных агроэкосистемах, каскадно распространяется через атмосферу, водные и наземные экосистемы, пока не преобразуется в N 2 , в первую очередь посредством денитрификации . [1] Хотя наземная денитрификация производит газообразные промежуточные продукты (оксид азота [NO] и закись азота [N 2 O]), последний шаг — микробное производство N 2 — имеет решающее значение, поскольку атмосферный N 2 является поглотителем Nr. [34] Многие исследования ясно продемонстрировали, что управляемые буферные полосы и водно-болотные угодья могут удалять значительные количества нитрата (NO 3 − ) из сельскохозяйственных систем посредством денитрификации . [35] Такое управление может помочь смягчить нежелательные каскадные эффекты и исключить накопление Nr в окружающей среде. [1]
Человеческая деятельность доминирует в глобальных и большинстве региональных циклов N. [36] Вложения N показали негативные последствия как для круговорота питательных веществ, так и для разнообразия местных видов в наземных и водных системах. Фактически, из-за долгосрочного воздействия на пищевые сети, поступления Nr широко считаются наиболее критической проблемой загрязнения в морских системах. [8] Как в наземных, так и в водных экосистемах реакции на обогащение N различаются; однако общей повторяющейся темой является важность пороговых значений (например, насыщение азотом ) в способности системы удерживать питательные вещества. Для того чтобы контролировать каскад N, должна быть интеграция научных дисциплин и дальнейшая работа по хранению Nr и скорости денитрификации . [34]
{{cite book}}: |journal=проигнорировано ( помощь )