
В науке неподеленная пара относится к паре валентных электронов , которые не являются общими с другим атомом в ковалентной связи [1] и иногда называется неподеленной парой или несвязывающей парой . Неподеленные пары находятся в самой внешней электронной оболочке атомов. Их можно идентифицировать с помощью структуры Льюиса . Поэтому электронные пары считаются неподеленными парами, если два электрона спарены, но не используются в химической связи . Таким образом, число электронов в неподеленных парах плюс число электронов в связях равно числу валентных электронов вокруг атома.
Неподеленная пара — это концепция, используемая в теории отталкивания электронных пар валентной оболочки (теория VSEPR), которая объясняет формы молекул . Они также упоминаются в химии кислот и оснований Льюиса . Однако не все несвязывающие пары электронов химики считают неподеленными парами. Примерами являются переходные металлы, где несвязывающие пары не влияют на молекулярную геометрию и считаются стереохимически неактивными. В теории молекулярных орбиталей (полностью делокализованные канонические орбитали или локализованные в какой-либо форме) концепция неподеленной пары менее определена, поскольку соответствие между орбиталью и компонентами структуры Льюиса часто не является однозначным. Тем не менее, занятые несвязывающие орбитали (или орбитали в основном несвязывающего характера) часто идентифицируются как неподеленные пары.
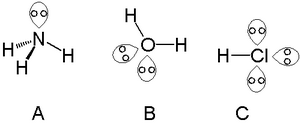
Одна неподеленная пара может быть найдена у атомов в группе азота , например, азота в аммиаке . Две неподеленные пары могут быть найдены у атомов в группе халькогенов , например, кислорода в воде. Галогены могут нести три неподеленные пары, например, в хлористом водороде .
В теории VSEPR электронные пары на атоме кислорода в воде образуют вершины тетраэдра с неподеленными парами на двух из четырех вершин. Угол связи H–O–H составляет 104,5°, что меньше 109°, предсказанных для тетраэдрического угла , и это можно объяснить отталкивающим взаимодействием между неподеленными парами. [2] [3] [4]
Были предложены различные вычислительные критерии наличия неподеленных пар. Хотя сама по себе плотность электронов ρ( r ) обычно не дает полезных указаний в этом отношении, лапласиан электронной плотности является показательным, и одним из критериев местоположения неподеленной пары является то, что L ( r ) = – ∇ 2 ρ( r ) является локальным максимумом. Минимумы электростатического потенциала V ( r ) являются еще одним предложенным критерием. Еще один рассматривает функцию локализации электронов (ELF). [5]

Пары часто проявляют отрицательный полярный характер с их высокой плотностью заряда и расположены ближе к ядру атома в среднем по сравнению со связывающей парой электронов. Наличие неподеленной пары уменьшает угол связи между связывающей парой электронов из-за их высокого электрического заряда, что вызывает большое отталкивание между электронами. Они также участвуют в образовании дативной связи . Например, создание иона гидроксония (H 3 O + ) происходит при растворении кислот в воде и обусловлено тем, что атом кислорода отдает неподеленную пару иону водорода .
Это можно увидеть более отчетливо, если посмотреть на это в двух более распространенных молекулах . Например, в диоксиде углерода (CO2 ) , который не имеет неподеленной пары, атомы кислорода находятся по разные стороны от атома углерода ( линейная молекулярная геометрия ), тогда как в воде ( H2O ), которая имеет две неподеленные пары, угол между атомами водорода составляет 104,5° ( изогнутая молекулярная геометрия ). Это вызвано отталкивающей силой двух неподеленных пар атома кислорода, которая отталкивает атомы водорода дальше друг от друга, пока силы всех электронов на атоме водорода не придут в равновесие . Это иллюстрация теории VSEPR .
Неподеленные пары могут вносить вклад в дипольный момент молекулы . NH 3 имеет дипольный момент 1,42 D. Поскольку электроотрицательность азота (3,04) больше, чем у водорода (2,2), в результате связи NH являются полярными с чистым отрицательным зарядом на атоме азота и меньшим чистым положительным зарядом на атомах водорода. Также существует диполь, связанный с неподеленной парой, и это усиливает вклад, вносимый полярными ковалентными связями NH в дипольный момент аммиака . В отличие от NH 3 , NF 3 имеет гораздо более низкий дипольный момент 0,234 D. Фтор более электроотрицателен , чем азот, и полярность связей NF противоположна полярности связей NH в аммиаке, так что диполь, обусловленный неподеленной парой, противостоит диполям связей NF, что приводит к низкомолекулярному дипольному моменту. [6]
Одинокая пара может способствовать существованию хиральности в молекуле, когда три другие группы, присоединенные к атому, все отличаются. Эффект наблюдается в некоторых аминах , фосфинах , [7] сульфоний- и оксониевых ионах , сульфоксидах и даже карбанионах .
Разделение энантиомеров , где стереогенный центр является амином, обычно затруднено, поскольку энергетический барьер для инверсии азота в стереоцентре низок, что позволяет двум стереоизомерам быстро преобразовываться друг в друга при комнатной температуре. В результате такие хиральные амины не могут быть разделены, если только группы амина не ограничены циклической структурой (например, в основании Трегера ).
Стереохимически активная неподеленная пара также ожидается для двухвалентных ионов свинца и олова из-за их формальной электронной конфигурации n s 2 . В твердом состоянии это приводит к искаженной координации металла, наблюдаемой в тетрагональной структуре глета , принятой как PbO, так и SnO. Недавно было показано, что образование этих тяжелых металлических неподеленных пар n s 2 , которое ранее приписывалось внутриатомной гибридизации состояний s и p металла [8], имеет сильную зависимость от аниона. [9] Эта зависимость от электронных состояний аниона может объяснить, почему некоторые двухвалентные материалы свинца и олова, такие как PbS и SnTe, не показывают стереохимических доказательств неподеленной пары и принимают симметричную кристаллическую структуру каменной соли. [10] [11]
В молекулярных системах неподеленная пара также может приводить к искажению координации лигандов вокруг иона металла. Эффект неподеленной пары свинца можно наблюдать в супрамолекулярных комплексах нитрата свинца(II) , а в 2007 году исследование связало неподеленную пару с отравлением свинцом . [12] Ионы свинца могут заменять ионы собственного металла в нескольких ключевых ферментах, таких как катионы цинка в ферменте ALAD , который также известен как порфобилиногенсинтаза , и играет важную роль в синтезе гема , ключевого компонента молекулы гемоглобина , переносящей кислород . Это ингибирование синтеза гема, по-видимому, является молекулярной основой отравления свинцом (также называемого «сатурнизмом» или «плюмбизмом»). [13] [14] [15]
Вычислительные эксперименты показывают, что хотя координационное число не меняется при замене в кальций-связывающих белках, введение свинца искажает способ самоорганизации лигандов для размещения такой возникающей неподеленной пары: следовательно, эти белки возмущены. Этот эффект неподеленной пары становится драматичным для цинк-связывающих белков, таких как вышеупомянутая порфобилиногенсинтаза, поскольку естественный субстрат больше не может связываться – в этих случаях белок ингибируется .
В элементах группы 14 ( группа углерода ) неподеленные пары могут проявляться путем сокращения или удлинения длин одинарных связей ( порядок связи 1) [16] , а также в эффективном порядке тройных связей . [17] [18] Знакомые алкины имеют тройную связь углерод-углерод ( порядок связи 3) и линейную геометрию углов связи 180° (рисунок A в ссылке [19] ). Однако ниже в группе ( кремний , германий и олово ) формальные тройные связи имеют эффективный порядок связи 2 с одной неподеленной парой (рисунок B [19] ) и транс -изогнутой геометрией. В свинце эффективный порядок связи еще больше уменьшается до одинарной связи с двумя неподеленными парами для каждого атома свинца (рисунок C [19] ). В германийорганическом соединении ( Схема 1 в источнике) эффективный порядок связи также равен 1, с комплексообразованием кислотных изонитрильных ( или изоцианидных ) групп CN, основанным на взаимодействии с пустой 4p-орбиталью германия. [19] [20]

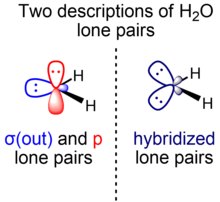
В элементарных курсах химии неподеленные пары воды описываются как «кроличьи уши»: две эквивалентные электронные пары приблизительно sp 3 гибридизации, в то время как угол связи HOH составляет 104,5°, что немного меньше идеального тетраэдрического угла arccos(–1/3) ≈ 109,47°. Меньший угол связи рационализируется теорией VSEPR , приписывая большее требование к пространству для двух идентичных неподеленных пар по сравнению с двумя парами связей. В более продвинутых курсах альтернативное объяснение этого явления рассматривает большую стабильность орбиталей с избыточным s-характером с использованием теории изовалентной гибридизации , в которой связи и неподеленные пары могут быть построены с помощью sp x- гибридов, в которых допускаются нецелые значения x , при условии сохранения общего количества s- и p-характеров (одна s- и три p-орбитали в случае p-блочных элементов второго ряда).
Чтобы определить гибридизацию кислородных орбиталей, используемых для образования пар связей и неподеленных пар воды на этой картинке, мы используем формулу 1 + x cos θ = 0, которая связывает угол связи θ с индексом гибридизации x . Согласно этой формуле, связи O–H считаются построенными из связывающих орбиталей O гибридизации ~sp 4.0 (~80% p-характер, ~20% s-характер), что оставляет позади орбитали неподеленных пар O гибридизации ~sp 2.3 (~70% p-характер, ~30% s-характер). Эти отклонения от идеализированной гибридизации sp 3 (75% p-характер, 25% s-характер) для тетраэдрической геометрии согласуются с правилом Бента : неподеленные пары локализуют больше электронной плотности ближе к центральному атому по сравнению со связывающими парами; Следовательно, использование орбиталей с избыточным s-характером для образования неподеленных пар (и, следовательно, с избыточным p-характером для образования связывающих пар) энергетически выгодно.
Однако теоретики часто предпочитают альтернативное описание воды, которое разделяет неподеленные пары воды в соответствии с симметрией относительно молекулярной плоскости. В этой модели существуют две энергетически и геометрически различные неподеленные пары воды, обладающие разной симметрией: одна (σ) в плоскости и симметрична относительно молекулярной плоскости, а другая (π) перпендикулярна и антисимметрична относительно молекулярной плоскости. Неподеленная пара с σ-симметрией (σ(out)) образована из гибридной орбитали, которая смешивает характер 2s и 2p, в то время как неподеленная пара с π-симметрией (p) имеет исключительное происхождение от орбитали 2p. Орбиталь неподеленной пары O σ(out), богатая символами s (также обозначается n O (σ) ), представляет собой гибрид ~sp 0,7 (~40% символа p, 60% символа s), в то время как орбиталь неподеленной пары p (также обозначается n O (π) ) состоит из 100% символа p.
Обе модели имеют ценность и представляют одну и ту же общую электронную плотность, причем орбитали связаны унитарным преобразованием . В этом случае мы можем построить две эквивалентные гибридные орбитали неподеленной пары h и h ', взяв линейные комбинации h = c 1 σ(out) + c 2 p и h ' = c 1 σ(out) – c 2 p для соответствующего выбора коэффициентов c 1 и c 2 . Для химических и физических свойств воды, которые зависят от общего электронного распределения молекулы, использование h и h ' так же допустимо, как использование σ(out) и p. В некоторых случаях такой взгляд интуитивно полезен. Например, стереоэлектронное требование для аномерного эффекта можно рационализировать с использованием эквивалентных неподеленных пар, поскольку имеет значение общая передача электронной плотности в антисвязывающую орбиталь. Альтернативный подход с использованием разделенных σ/π неподеленных пар также допустим, но он требует достижения баланса между максимизацией перекрытия n O (π) -σ* (максимум при двугранном угле 90°) и перекрытием n O (σ) -σ* (максимум при двугранном угле 0°), компромисс, который приводит к выводу, что гош -конформация (двугранный угол 60°) является наиболее благоприятной, тот же вывод, который модель эквивалентных неподеленных пар рационализирует гораздо более прямолинейным образом. [21] Аналогично, водородные связи воды образуются вдоль направлений неподеленных пар «кроличьих ушей», как отражение повышенной доступности электронов в этих областях. Эта точка зрения поддерживается вычислительно. [5] Однако, поскольку только канонические орбитали, адаптированные к симметрии, имеют физически значимую энергию, явления, связанные с энергиями отдельных орбиталей, такие как фотохимическая реактивность или фотоэлектронная спектроскопия , проще всего объяснить с помощью неподеленных пар σ и π, которые соблюдают молекулярную симметрию. [21] [22]
Из-за популярности теории VSEPR , трактовка неподеленных пар воды как эквивалентных распространена во вводных курсах химии, и многие практикующие химики продолжают считать ее полезной моделью. Похожая ситуация возникает при описании двух неподеленных пар на атоме кислорода карбонила кетона. [23] Однако вопрос о том, концептуально ли полезно выводить эквивалентные орбитали из адаптированных к симметрии, с точки зрения теории связей и педагогики, все еще остается спорным, с недавними (2014 и 2015) статьями, выступающими против [24] и поддерживающими [25] эту практику.
{{cite book}}: CS1 maint: местоположение отсутствует издатель ( ссылка ) CS1 maint: несколько имен: список авторов ( ссылка )