Оогоний ( мн. ч .: oogonia ) — небольшая диплоидная клетка, которая при созревании образует примордиальный фолликул у женского плода или женский (гаплоидный или диплоидный) гаметангий некоторых таллофитов .
Оогонии образуются в большом количестве путем митоза на ранних стадиях развития плода из первичных зародышевых клеток . У людей они начинают развиваться между 4 и 8 неделями и присутствуют у плода между 5 и 30 неделями.
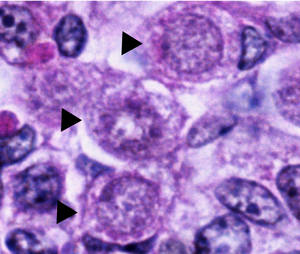
Нормальные оогонии в яичниках человека имеют сферическую или яйцевидную форму и находятся среди соседних соматических клеток и ооцитов на разных фазах развития. Оогонии можно отличить от соседних соматических клеток под электронным микроскопом , наблюдая за их ядрами . Ядра оогоний содержат беспорядочно распределенный фибриллярный и гранулярный материал, тогда как соматические клетки имеют более уплотненное ядро, которое создает более темный контур под микроскопом. Ядра оогоний также содержат плотные выступающие ядрышки . Хромосомный материал в ядре митотически делящихся оогоний выглядит как плотная масса, окруженная пузырьками или двойными мембранами. [1]
Цитоплазма оогоний выглядит похожей на цитоплазму окружающих соматических клеток и также содержит большие круглые митохондрии с боковыми кристами . Однако эндоплазматический ретикулум (ЭР ) оогоний очень слабо развит и состоит из нескольких мелких пузырьков. Некоторые из этих мелких пузырьков содержат цистерны с рибосомами и расположены вблизи аппарата Гольджи . [1]
Оогонии, которые подвергаются дегенерации, выглядят немного по-другому под электронным микроскопом. В этих оогониях хромосомы слипаются в неразличимую массу внутри ядра, а митохондрии и ЭР кажутся опухшими и разрушенными. Дегенерирующие оогонии обычно обнаруживаются частично или полностью поглощенными соседними соматическими клетками, что указывает на фагоцитоз как способ элиминации. [1]
В бластоцисте эмбриона млекопитающего первичные половые клетки возникают из проксимальных эпибластов под влиянием внеэмбриональных сигналов. Затем эти половые клетки перемещаются посредством амебоидного движения в генитальный гребень и в конечном итоге в недифференцированные гонады плода. [2] На 4-й или 5-й неделе развития гонады начинают дифференцироваться. При отсутствии Y-хромосомы гонады будут дифференцироваться в яичники. По мере дифференциации яичников развиваются врастания, называемые кортикальными тяжами. Именно там собираются первичные половые клетки. [3] [4]
В течение 6-8-й недели женского (XX) эмбрионального развития первичные зародышевые клетки растут и начинают дифференцироваться в оогонии. Оогонии размножаются посредством митоза в течение 9-22-й недели эмбрионального развития. К 8-й неделе развития может быть до 600 000 оогоний, а к 5-му месяцу — до 7 000 000. [3]
В конце концов, оогонии либо дегенерируют, либо далее дифференцируются в первичные ооциты посредством асимметричного деления. Асимметричное деление — это процесс митоза, в котором один оогоний делится неравномерно, чтобы произвести одну дочернюю клетку, которая в конечном итоге станет ооцитом посредством процесса оогенеза , и одну дочернюю клетку, которая является оогонием, идентичным родительской клетке. Это происходит в течение 15-й недели — 7-го месяца эмбрионального развития. [2] Большинство оогоний либо дегенерируют, либо дифференцируются в первичные ооциты к моменту рождения. [3] [5]
Первичные ооциты будут проходить оогенез, в ходе которого они вступают в мейоз . Однако первичные ооциты останавливаются в профазе 1 первого мейоза и остаются в этой остановленной стадии до наступления половой зрелости у взрослой особи женского пола. [6] Это отличается от мужских первичных половых клеток, которые останавливаются на сперматогониевой стадии при рождении и не вступают в сперматогенез и мейоз для производства первичных сперматоцитов до наступления половой зрелости у взрослого мужчины. [3]
Регуляция и дифференциация половых клеток в первичные гаметоциты в конечном итоге зависят от пола эмбриона и дифференциации гонад. У самок мышей белок RSPO1 отвечает за дифференциацию женских (XX) гонад в яичники . RSPO1 активирует сигнальный путь β-катенина , повышая регуляцию Wnt4, что является важным шагом в дифференциации яичников. Исследования показали, что яичники, в которых отсутствует Rspo1 или Wnt4, будут демонстрировать смену пола гонад, образование овотестисов и дифференциацию соматических клеток Сертоли , которые способствуют развитию сперматозоидов . [4]
После того, как женские (XX) половые клетки собираются в недифференцированных гонадах, для дифференциации половых клеток в оогоний и в конечном итоге вхождения в мейоз требуется повышение регуляции Stra8 . Одним из основных факторов, способствующих повышению регуляции Stra8 , является инициация сигнального пути β-катенина через RSPO1, который также отвечает за дифференциацию яичников. Поскольку RSPO1 вырабатывается в соматических клетках, этот белок действует на половые клетки паракринным образом . Однако Rspo1 не является единственным фактором в регуляции Stra8 . Многие другие факторы находятся под пристальным вниманием, и этот процесс все еще оценивается. [4]
Предполагается, что оогонии либо дегенерируют, либо дифференцируются в первичные ооциты , которые вступают в оогенез и останавливаются в профазе I первого мейоза после родов. Поэтому считается, что у взрослых самок млекопитающих отсутствует популяция зародышевых клеток, которые могут обновляться или регенерировать, и вместо этого у них есть большая популяция первичных ооцитов, которые останавливаются в первом мейозе до полового созревания . [2] В период полового созревания один первичный ооцит будет продолжать мейоз каждый менструальный цикл . Поскольку у человека отсутствуют регенерирующие зародышевые клетки и оогонии, количество первичных ооцитов уменьшается после каждого менструального цикла до менопаузы , когда у самки больше нет популяции первичных ооцитов. [2]
Однако недавние исследования выявили, что возобновляемые оогонии могут присутствовать в слизистой оболочке женских яичников человека, приматов и мышей. [2] [7] [8] Считается, что эти зародышевые клетки могут быть необходимы для поддержания репродуктивных фолликулов и развития ооцитов даже во взрослом возрасте. Также было обнаружено, что некоторые стволовые клетки могут мигрировать из костного мозга в яичники в качестве источника экстрагениальных зародышевых клеток. Эти митотически активные зародышевые клетки, обнаруженные у взрослых млекопитающих, были идентифицированы путем отслеживания нескольких маркеров, которые были распространены в ооцитах. Эти потенциально возобновляемые зародышевые клетки были идентифицированы как положительные по этим основным маркерам ооцитов. [2]
Открытие этих активных половых клеток и оогоний у взрослой самки может быть очень полезным для продвижения исследований фертильности и лечения бесплодия. [2] [8] Половые клетки были извлечены, изолированы и успешно выращены in vitro . [8] Эти половые клетки использовались для восстановления фертильности у мышей, способствуя образованию и поддержанию фолликулов у ранее бесплодных мышей. Также проводятся исследования возможной регенерации зародышевой линии у приматов. Митотически активные женские половые клетки человека могут быть очень полезны для нового метода развития эмбриональных стволовых клеток, который включает перенос ядра в зиготу . Использование этих функциональных оогоний может помочь создать линии стволовых клеток, специфичные для пациента, с использованием этого метода. [2]
Существует значительное противоречие относительно существования оогониальных стволовых клеток млекопитающих. Противоречие заключается в отрицательных данных, которые исходят из многих лабораторий в Соединенных Штатах. Многочисленные подходы к проверке существования оогониальных стволовых клеток дали отрицательные результаты, и ни одна исследовательская группа в Соединенных Штатах не смогла воспроизвести первоначальные результаты. [9] [10] [11]
.jpg/440px-Oogonium_--_3_(34809275943).jpg)
В альгологии и микологии оогоний относится к женскому гаметангию , если объединение мужской (подвижной или неподвижной) и женской гамет происходит внутри этой структуры. [12] [13]
У Oomycota и некоторых других организмов женские оогонии и мужские эквивалентные антеридии являются результатом половой споруляции, то есть развития структур, в которых будет происходить мейоз. Гаплоидные ядра (гаметы) образуются путем мейоза в антеридиях и оогониях, и когда происходит оплодотворение, образуется диплоидная ооспора , которая в конечном итоге прорастет в диплоидную соматическую стадию жизненного цикла таллофита. [14]
У многих водорослей (например, Chara ) основное растение гаплоидное; оогонии и антеридии образуют и производят гаплоидные гаметы. Единственной диплоидной частью жизненного цикла является спора (оплодотворенная яйцеклетка), которая подвергается мейозу для образования гаплоидных клеток, которые развиваются в новые растения. Это гаплоидный жизненный цикл (с зиготическим мейозом ).
Оогонии некоторых видов Thallophyte [ какие? ] обычно круглые или яйцевидные, с содержимым, разделенным на несколько одноядерных оосфер . Это контрастирует с мужскими антеридиями, которые удлиненные и содержат несколько ядер. [14]
У гетероталличных видов оогонии и антеридии расположены на гифальных ветвях разных колоний таллофитов. Оогонии этого вида могут быть оплодотворены только антеридиями из другой колонии, что гарантирует невозможность самооплодотворения. [ необходимо уточнение ] Напротив, гомоталличные виды демонстрируют оогонии и антеридии либо на одной гифальной ветви, либо на отдельных гифальных ветвях, но в пределах одной колонии. [14]
В общем способе оплодотворения, обнаруженном у некоторых видов Thallophytes, антеридии связываются с оогониями. Затем антеридии образуют трубки оплодотворения, соединяющие цитоплазму антеридиев с каждой оосферой внутри оогония. Гаплоидное ядро (гамета) из антеридия затем переносится через трубку оплодотворения в оосферу и сливается с гаплоидным ядром оосферы, образуя диплоидную ооспору. Затем ооспора готова прорасти и развиться во взрослую диплоидную соматическую стадию. [14]
Список различных типов клеток в организме взрослого человека