Орипавин — опиоид и основной метаболит тебаина . Это исходное соединение, из которого получен ряд полусинтетических опиоидов , включая соединения эторфин и бупренорфин . Хотя его анальгетическая сила сопоставима с морфином , он не используется в клинических условиях из-за его сильной токсичности и низкого терапевтического индекса . Будучи предшественником ряда чрезвычайно сильных опиоидов , орипавин является контролируемым веществом в некоторых юрисдикциях.
Орипавин обладает анальгезирующей силой, сравнимой с морфином; однако, он не является клинически полезным из-за тяжелой токсичности и низкого терапевтического индекса . Как у мышей , так и у крыс токсические дозы вызывали тонико-клонические судороги, за которыми следовала смерть, подобно тебаину . [1] Орипавин имеет потенциал зависимости , который значительно больше, чем у тебаина , но немного меньше, чем у морфина . [2]
Гораздо более важными являются свойства орвинолов, большого семейства полусинтетических производных орипавина, классически синтезируемых реакцией Дильса-Альдера тебаина с соответствующим диенофилом с последующим 3- O -деметилированием до соответствующего мостикового орипавина. Эти соединения были разработаны группой под руководством К. В. Бентли в 1960-х годах, и эти соединения Бентли представляют собой первую серию «супермощных» μ-опиоидных агонистов, причем некоторые соединения в серии более чем в 10 000 раз превосходят по силе морфин в качестве анальгетика. [3] [4] [5] Простое мостиковое исходное соединение орипавина 6,14-эндоэтенотетрагидроорипавин уже в 40 раз превосходит по силе морфин, [6] но добавление разветвленного заместителя третичного спирта в положение C7 приводит к широкому спектру высокомощных соединений. [7]
Другие примечательные производные затем являются результатом дальнейшей модификации этого шаблона, с насыщением 7,8-двойной связи эторфина, что приводит к еще более сильному дигидроэторфину (до 12 000 раз сильнее морфина) и ацетилированием 3-гидроксигруппы эторфина, что приводит к ацеторфину (в 8700 раз сильнее морфина) — хотя в то время как изопентиловый гомолог эторфина почти в три раза сильнее, его 7,8-дигидро- и 3-ацетилпроизводные менее эффективны, чем соответствующие производные эторфина, в 11 000 и 1300 раз сильнее морфина соответственно. Замена N -метильной группы на циклопропилметильную приводит к получению опиоидных антагонистов, таких как дипренорфин (M5050, который используется в качестве антидота для устранения эффектов эторфина, M99), и частичных агонистов , таких как бупренорфин , который широко используется при лечении опиоидной зависимости .
В связи с относительной легкостью синтетической модификации орипавина для получения других наркотиков (как прямым, так и косвенным путем через тебаин ), Комитет экспертов Всемирной организации здравоохранения по наркотической зависимости в 2003 году рекомендовал включить орипавин в Список I Единой конвенции о наркотических средствах 1961 года . [8] 14 марта 2007 года Комиссия Организации Объединенных Наций по наркотическим средствам официально решила принять эти рекомендации и поместила орипавин в Список I. [9]
До недавнего времени орипавин был препаратом Списка II в Соединенных Штатах по умолчанию как производное тебаина , хотя он не был явно указан. Однако, как государство-участник Единой конвенции о наркотических средствах 1961 года , США были обязаны специально контролировать это вещество в соответствии с Законом о контролируемых веществах после его международного контроля Комиссией ООН по наркотическим средствам. 24 сентября 2007 года Управление по борьбе с наркотиками официально добавило орипавин в Список II. [10]
В соответствии с Законом о контролируемых веществах 1970 года орипавин имеет ACSCN 9330 и квоту на производство в 2013 году в размере 22 750 кг (50 160 фунтов).
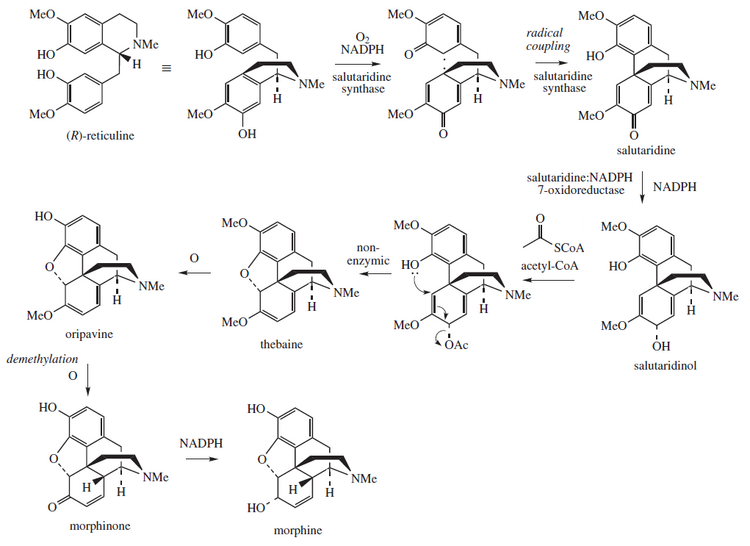
Эта молекула биосинтетически связана с метаболизмом производных морфинана , в котором участвуют тебаин и морфин . [11]