
Защемление нерва включает каскад физиологических изменений, вызванных сжатием и натяжением. Некоторые из этих изменений необратимы. [1] Величина и продолжительность сил определяют степень повреждения. [2] В острой форме механическое повреждение и метаболические блоки препятствуют функции нерва. В хронической форме наблюдается последовательность изменений, начинающихся с разрушения гематоэнцефалического барьера, за которым следует отек с изменениями соединительной ткани, затем диффузная демиелинизация и, наконец, аксонметезис. [3] Травма часто будет смешанным поражением, где легкая/умеренная компрессия представляет собой комбинацию метаболического блока и нейропраксии , в то время как тяжелая компрессия сочетает элементы нейропраксии и аксонметезис. [4] [2]

Нервные клетки состоят из небольшого тела клетки и очень длинного сегмента, называемого аксоном . Тело клетки находится в спинном мозге, а аксон простирается до цели иннервации нерва. Аксоны периферических нервов могут быть длиннее 100 см, так как им может потребоваться пройти по всей длине конечности, чтобы достичь цели иннервации, в то время как длина тела клетки составляет всего 100 микрометров. [4] Нервы могут быть миелинизированными или немиелинизированными. У миелинизированных нервов аксон покрыт сегментами шванновских клеток , которые короткие и концентрически обернуты вокруг диаметра аксона, создавая вид сосискообразной массы и называемой миелиновой оболочкой. Шванновские клетки расположены таким образом, что все части аксона обернуты шванновскими клетками, а последовательные шванновские клетки разделены очень небольшим расстоянием. Этот разделительный зазор называется перехватом Ранвье . [3] Немиелинизированные нервы также окружены шванновскими клетками, но шванновские клетки не обертываются вокруг аксона несколько раз, образуя миелиновую оболочку.

Аксоны нервных клеток окружены различными слоями соединительной ткани и связаны вместе в структуру, называемую нервным волокном. На поверхности нервного волокна находится слой ткани, называемый эпиневрием или иногда внешним эпиневрием. Внутри эпиневрия находится соединительнотканная матрица, называемая внутренним эпиневрием, и пучки . Внутренний эпиневрий действует как мягкая подушка для пучков. [5] Нервное волокно может иметь различное количество пучков, но будет по крайней мере один (иначе не было бы нервных клеток). Пучки окружены слоем ткани, называемым периневрием , который является защитной оболочкой, действующей как барьер. Внутри пучков находится эндоневрий , тканевая матрица, аналогичная внутреннему эпиневрию, и нервные клетки. [3] Эндоневрий имеет множество мелких кровеносных капилляров (эндоневральных микрососудов), которые напрямую снабжают сами нервы. Эти капилляры имеют плотные соединения, что препятствует свободному движению материалов между клетками и вместо этого требует, чтобы вещества проходили через эндотелиальные клетки.
Периферический гематоэнцефалический барьер аналогичен гематоэнцефалическому барьеру. Как и гематоэнцефалический барьер, гематоэнцефалический барьер создает стабильную, привилегированную среду, через которую определенные вещества не могут пройти из-за плотных соединений. Гематоэнцефалический барьер состоит из внутренних клеток периневрия и эндотелиальных клеток эндоневральных микрососудов . [3]
Защемление нерва вызывается в первую очередь двумя физическими силами, действующими на мягкие ткани: сжатием и растяжением. [4] Сжатие сдавливает нерв и нарушает его местную микроциркуляторную среду, что обычно происходит в анатомических туннелях. Натяжение — это тянущая сила, часто вызываемая рубцеванием, которое затрудняет подвижность нерва во время движений конечностей. Как величина, так и продолжительность этих сил могут определять степень повреждения. [2] [3] [6]
Давление может нарушить или остановить микроциркуляторную среду нерва, запуская патофизиологический каскад. [4] [2] Когда сердце бьется, оно проталкивает кровь через артерии/артериолы/капилляры. Кровь также движется по венам, хотя и более пассивно, через клапаны и с помощью мышц, сжимающих вены. Если локализованное давление достаточно высокое, оно может нарушить нормальный поток крови.
Чтобы компрессия повлияла на функцию нерва, давление должно быть приложено неравномерно. Например, лягушки могут выживать в изолированных барокамерах при высоком давлении, но гораздо более низкое локальное сжатие может блокировать проводимость нерва. [5] Аквалангисты могут погружаться на глубину в десятки метров и не испытывать никакой формы компрессии нерва, но то же самое давление, которое испытывают водолазы на глубине 1 метр (давление под 1 м воды составляет 10 кПа ~ 80 мм рт. ст.), приложенное локально, может полностью остановить функцию нерва. [7]
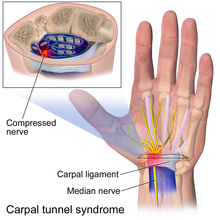
Сжатие особенно вероятно в анатомических туннелях или фиброзно-костных пространствах, где может возникнуть конфликт между количеством свободного пространства и объемом содержимого. [2] [1] Если туннель сужается или содержимое туннеля расширяется, давление увеличится. Примерами туннелей являются запястный туннель , тарзальный туннель и кубитальный туннель . Иногда сжатие происходит в областях, которые не считаются туннелями, и где нерв проходит между двумя механически более жесткими типами тканей, которые могут сдавливать или защемлять мягкий нерв. Примерами являются латеральный бедренный кожный нерв в паховой связке [8] и средние ягодичные нервы в длинной задней крестцово-подвздошной связке . [9] Сжатие может быть даже динамическим, когда сжатие может присутствовать только во время определенных действий и положений. [1] При глубоком ягодичном синдроме у пациентов часто возникает радикулопатия седалищного нерва, когда они сидят, но не стоят. [10]
Исследования компрессии и функции нервов обнаружили дозозависимую зависимость между давлением и продолжительностью. То есть более высокое давление и большая продолжительность связаны с большей дисфункцией. Однако даже короткие, но повторяющиеся периоды компрессии могут также повредить микроциркуляторную среду нерва. Величина давления, необходимая для того, чтобы вызвать дисфункцию нерва, начинается примерно с 20 мм рт. ст., когда снижается эпиневральный венозный кровоток. [3] При 30 мм рт. ст. нарушается антеградный и ретроградный аксональный транспорт. [3] Между 30 и 50 мм рт. ст. обычно одновременно происходят изменения интраневрального кровотока, аксонального транспорта и сосудистой проницаемости. [4] А при 80 мм рт. ст. весь интраневральный кровоток останавливается, что приводит к полной метаболической блокаде. [3] Величина давления, необходимая для нарушения интраневрального кровотока, не является абсолютным давлением, а скорее функцией артериального кровяного давления и перфузионного давления. [5] Пациенты с более высоким кровяным давлением в некоторой степени защищены от последствий защемления нерва, поскольку для прерывания интраневрального кровотока им требуется более высокое давление. Если эти же пациенты успешно лечатся от гипертонии, у них могут развиться симптомы, если у них уже была некоторая латентная, субклиническая форма сдавления нерва. [3]

Периферические нервы часто скользят во время движения конечностей. [2] Например, плечевое сплетение может перемещаться на расстояние до 50 мм при отведении и приведении плеча. Срединный/локтевой нервы перемещаются на расстояние 7,3 мм и 9,8 мм при сгибании и разгибании локтя в локте. Срединный нерв перемещается на расстояние 9,6 мм при сгибании и разгибании запястья. [2] Это движение нерва также относится к спинномозговым нервам, которые могут растягиваться и ослабевать при движении позвоночника. [4] Это скольжение нерва происходит в интраневральных и экстраневральных тканевых плоскостях. Снаружи нерва тонкий слой ткани, похожий на адвентицию, окружает нерв, по которому скользит эпиневральная поверхность. Внутри нерва пучки могут скользить друг по другу. [2] [3]
Торможение нормального скольжения в этих плоскостях тканей может привести к повторяющимся травмам растяжения во время движений. Исследования седалищных нервов кроликов показали, что даже 6% острого растяжения может привести к значительному ухудшению с восстановлением, а 12% острого растяжения может привести к полному ухудшению без немедленного восстановления. [6] Одна спайка связывает нерв в двух направлениях — между спинномозговым корешком и спайкой и между спайкой и конечными ветвями. Эти травмы приведут к отеку и фиброзу не только в нерве, но и в окружающих тканях, соприкасающихся с нервом, что может еще больше препятствовать нормальному скольжению нерва в порочном круге. [2]
Наиболее часто понимаемый механизм нарушения скольжения нерва заключается в образовании рубцовой ткани, которая склеивает отдельные плоскости тканей. Не всегда ясно, как формируется первоначальная рубцовая ткань, но после ее образования становится очевидным путь для образования дальнейшей рубцовой ткани — движение может вызвать растяжение мягких тканей, прикрепленных к спайке, вызывая отек и дальнейший фиброз нервного ложа и потенциально распространяясь внутри самого нерва. При глубоком ягодичном синдроме проблема рубцов является наиболее распространенной причиной ущемления седалищного нерва. [11]
Патофизиология защемления сложна, поскольку нервная ткань состоит из многих компонентов (например, аксон, миелин, эндоневрий, периневрий, эпиневрий, кровеносные сосуды и т. д.), которые могут по-разному реагировать на различные стрессоры, влияющие на функцию нерва. [5] Основной механизм травмы обычно начинается с перерывов в кровоснабжении. [2] Как острая, так и хроническая формы защемления нерва включают начальные изменения в микроциркуляторной среде. Для острой модели последовательность событий обычно представляет собой перерыв в кровоснабжении, за которым следует метаболический блок, поскольку нерв перестает функционировать. Для хронической модели последовательность событий представляет собой разрушение гематоэнцефалического барьера, за которым следует эндоневриальный отек и фиброз соединительной ткани, за которыми следует демиелинизация и, наконец, аксонметезис. [3]
Прямое давление может физически деформировать структуру нерва. Локальное давление может создать двунаправленное смещение нервной ткани от области сжатия, сдавливая сжатую ткань наружу. [4] Исследования с использованием манжеты для сжатия нерва обнаружили самые ранние и самые серьезные повреждения на краю манжеты, и это называется «эффектом края». [2] [3] Считается, что физической основой эффекта края является градиент давления, который деформирует, а затем повреждает нервную ткань, и градиент давления является самым высоким на краях. [4] [5] [2] На микроскопическом уровне интраневральные кровеносные сосуды и нервные волокна смещаются продольно под действием деформации сдвига. [2] Удивительно, но более мелкие нервные волокна более устойчивы к сжатию, чем крупные нервные волокна. [5]
Функция нерва зависит от его кровоснабжения. Остановка или подавление кровоснабжения может лишить нервную ткань кислорода и других необходимых питательных веществ, что вызовет метаболический блок, в результате чего нерв не сможет функционировать. [4] Этот блок является чисто физиологической проблемой, так что структура нерва не изменяется. [2] Если метаболический блок кратковременный, он полностью обратим без постоянных эффектов. Примером метаболического блока является ситуация, когда конечность «засыпает» (временное онемение, парестезия и слабость) из-за положения конечности, которое ограничивает кровоток. Полная ишемия , такая как наложение жгута , сопровождается повышенной возбудимостью и затем потерей нервной функции в течение 60-90 минут. [4] Ишемия немедленно обратима после снятия блока, если продолжительность ишемии не слишком велика, например, 1-2 часа. [2] [4]
Первый признак нарушения интраневрального кровотока возникает в эпиневральных кровеносных сосудах при давлении около 20-30 мм рт. ст. При давлении 60-80 мм рт. ст. будет полная ишемия. [4] Метаболический блок также может быть вызван растяжением. В исследованиях на животных венозный застой наблюдался при растяжении на 8%, а при растяжении на 15% кровоснабжение полностью прекращалось. [4]
Часто пациенты, которым проводится декомпрессия нерва , отмечают немедленное улучшение симптомов, и считается, что это связано с восстановлением кровотока после метаболического блока, поскольку другие формы функциональных нарушений нервов, такие как нейропраксия и аксонметезис, требуют больше времени для восстановления. [4]
Как и острое сжатие, хроническое сжатие начинается с нарушения микроциркуляторной среды. Исследования давления выявили «критический уровень давления», выше которого нерв значительно повреждается. [5] Этот уровень давления на 30 мм рт. ст. ниже диастолического или на 45 мм рт. ст. ниже систолического артериального давления . [12] Интересно, что пациентам с более высоким артериальным давлением требуются большие компрессионные силы для нарушения микроциркуляторной среды. [5] [2]
Интраневральные кровеносные сосуды, подобно другим микрососудам в организме человека, увеличивают свою проницаемость в ответ на стресс. [4] В течение длительных периодов метаболического стресса, таких как ишемия, вызванная сжатием, проницаемость гемато-нервного барьера увеличивается. Это увеличение проницаемости гемато-нервного барьера является первым патологическим симптомом, наблюдаемым во время исследований сжатий. [3]
По мере разрушения гематоэнцефалического барьера белки и клетки смогут проникать в периневральное и эндоневральное пространство. Повышенная проницаемость, позволяющая проникать веществам, в сочетании с отсутствием лимфатической системы для отвода жидкостей [2] [4] вызывает повышение давления и может изменить ионную среду. [4] Повышенное давление в эндоневрии может вызвать мини- синдром «компартмента », приводящий к посттравматической ишемии нервных клеток. [4] [5] Когда возникает эндоневральный отек , отек будет длиться много часов до момента устранения защемления. Например, после 2–8 часов компрессии давление эндоневральной жидкости быстро возрастет и может оставаться повышенным в течение 24 часов. [2]
Лимфоциты, фибробласты и макрофаги также смогут пересекать недавно проницаемый гематоэнцефалический барьер и реагировать на антигены, содержащиеся в периневральном пространстве, вызывая воспалительную реакцию. [3] В рамках этой воспалительной реакции будут избыточные отложения фибрина (т. е. рубцевание). При гистологическом анализе можно увидеть эпиневральный фиброз и периневральное утолщение. [13] Это рубцевание является необратимым изменением, связанным с ущемлением нерва. [1] Если рубцевание повреждает микроциркуляторную среду, то нарушение кровоснабжения также будет постоянным. В случаях, когда постоянное нарушение существует даже после декомпрессии нерва, считается, что патофизиологическая основа обусловлена обширным рубцеванием вдоль и внутри нерва, поскольку демиелинизация и аксонметез, как правило, способны заживать, но рубцевание необратимо. [5]
К тому времени, когда хроническая компрессия нерва становится симптоматической, миелиновая ткань в области компрессии, вероятно, повреждена, что запускает процесс, называемый демиелинизацией . Это влияет только на миелиновую оболочку миелинизированного аксона, в то время как непрерывность аксона и нерва остается сохраненной. [2] Потеря миелина часто легко наблюдается в гистологических образцах, поскольку слой миелина вокруг миелинизированных нервов будет казаться очень тонким, что представляет собой либо поздние стадии демиелинизации, либо ранние стадии ремиелинизации. [14]
Патология пучка может различаться. [14] [15] Например, в некоторых исследованиях центральные пучки выглядели нормальными, в то время как периферические пучки показали значительное истончение миелина. [15] Даже внутри пучка демиелинизация не влияет на нервы равномерно. Например, на ранних стадиях демиелинизация может наблюдаться на краю пучков вблизи периферии нерва, а на более поздних стадиях демиелинизация диффузно наблюдается по всему пучку. [5] [16]
Повреждение миелиновой оболочки нервов является травмой нерва. Это классифицируется как нейропраксия или повреждение нерва типа 1 по классификации Сандерленда . [2] Это может вызвать локальный блок проводимости на недели или месяцы, пока миелиновые оболочки восстанавливаются, при условии отсутствия повторной травмы, которая продлит восстановление. [2]
При тяжелом защемлении нерва нервные аксоны могут быть повреждены до точки разрушения. Повреждение аксона также известно как аксонметезис или повреждение нерва типа 2 по Сандерленду , при котором сохраняются эндоневральные трубки. [2] Если аксон поврежден, аксональная транспортная система может не функционировать. Поскольку аксон зависит от своей связи с телом клетки, нарушенный аксональный транспорт вызовет сегментарную гибель аксона, дистальнее места повреждения, в процессе, называемом валлеровской дегенерацией . [4] Это приведет к полной блокаде проводимости, что приведет к мышечной слабости (двигательный нерв) или онемению (чувствительный нерв). При условии, что эндоневральная трубка не повреждена, все еще есть путь для восстановления аксона в месте повреждения, но рост происходит очень медленно (приблизительно 1 мм/день). [4] Восстановление может занять месяцы и часто бывает частичным. [17]
Ущемление нерва — это сложное поражение, включающее несколько типов тканей в пучке. [5] Могут быть смешанные поражения, когда отдельные поражения тканей способствуют возникновению всех симптомов. Повреждение тканей может способствовать возникновению положительных и/или отрицательных симптомов, которые можно объяснить потерей нервной функции и повышенной возбудимостью нервной ткани. [4] [2] Кроме того, нервные волокна могут по-разному поражаться компрессией/ишемией в зависимости от их размера, расположения и топографии. [2] Исследования на тканях человека не обнаружили четкой корреляции между объемом структурного повреждения нерва и степенью симптомов. У пациентов могут быть значительные симптомы без изменений нервных волокон. [14]
Негативные симптомы — это те, при которых функция утрачена: мышечная слабость , атрофия , онемение , сниженные или отсутствующие рефлексы . Эти симптомы представляют собой блокаду проводимости, при которой нервные сигналы не могут адекватно передаваться по всей длине нерва. Эти симптомы вызваны, в частности, метаболическими блоками, демиелинизацией и аксонметезисом. Метаболический блок — это временное лишение питания от кровоснабжения, которое легко устраняется, если ишемия не длится слишком долго. [4] Демиелинизация будет мешать проведению сигналов по нерву. [4] Аксонметезис приведет к полному блоку проводимости, поскольку валлеровская дегенерация разрушит каждую часть аксона, дистальнее поражения, если/пока аксон полностью не восстановится до своей самой дистальной цели иннервации.
Положительные симптомы — это те, для которых функция приобретается: парестезии , повышенная чувствительность , боль , мышечные спазмы , фасцикуляции . Симптомы представляют собой повышенную возбудимость нерва, когда сигнал посылается по нерву из-за более низкого порога активации, что приводит к спонтанным сигналам. Демиелинизация может вызывать положительные сенсорные симптомы, такие как боль из-за повышенной эктопической активности. [18] [4] Было обнаружено, что демиелинизированная нервная ткань имеет более низкий порог активации для отправки сигнала, особенно для механочувствительности (например, легкого прикосновения). Хотя есть некоторые споры о роли сенсибилизации центральной нервной системы в болезненных невропатиях захвата, успех периферических нервных блокад предполагает периферическое нервное происхождение этой невропатической боли. [19]
Поскольку большинство случаев защемления нервов не затрагивают структурную целостность эндоневрия , периневрия или эпиневрия , повреждения нервов от защемления нервов будут в первую очередь относиться к типу I или II по классификации Сандерленда . Поскольку защемление нервов может оставлять отдельные нервы на разных стадиях повреждения, могут присутствовать смешанные поражения. Например, легкое/умеренное защемление может в значительной степени сопровождаться наложением метаболического блока и повреждения типа I (локальное повреждение миелиновой оболочки). Умеренное/тяжелое защемление может сопровождаться повреждениями типа I и II одновременно (повреждение миелиновой оболочки и повреждение аксона). [2]
Синдром двойного сдавливания — это теория повреждения нерва, впервые предложенная Аптоном и Томасом в 1972 году. [2] [3] Теория двойного сдавливания считается несколько спорной, поскольку существуют разногласия относительно ее существования и основных механизмов, которые могут ее вызывать. [20] [21] Она утверждает, что нейронная функция нарушается, поскольку отдельные аксоны , будучи сжатыми в одном месте, подвержены дальнейшей невропатии из-за повреждения в другом месте. [22] Это происходит из-за нарушения механизма антероградного аксонального транспорта, и при множественных поражениях, нарушающих антероградный аксональный транспорт, антероградная транспортная система будет больше всего затронута как раз дистальнее самого дистального ущемления. Основой этой теории был высокий уровень шейной радикулопатии, наблюдаемый у пациентов с синдромом запястного канала . [21] [22] Концептуально это аналогично нескольким фильтрам для воды в системе фильтрации (один для крупных частиц, один для бактерий и т. д.). Вода будет чище сразу после последнего фильтра, но фильтрация была обусловлена совокупным эффектом отдельных фильтров. Чтобы отключить фильтрацию, необходимо снять каждый из фильтров, а не последний фильтр.
Структура периферических нервов включает небольшое тело клетки в спинном мозге и очень длинный аксон, который простирается до цели иннервации. Эти нервы имеют длину 1-1,5 метра (седалищный нерв). Большая часть веществ, необходимых аксону для выживания, производится в теле клетки. [2] Выживание аксона зависит от его связи с телом клетки, поддерживаемой механизмами аксонального транспорта для переноса клеточного материала. [4] Аксональная транспортная система переносит материал по аксону в обоих направлениях (антероградно и ретроградно) с разной скоростью (быстро и медленно). [4] [5] Быстрый транспорт перемещается со скоростью до 400 мм/день. Медленный транспорт составляет менее 8 мм/день. [23] При сжатии, недостаточно сильном, чтобы вызвать аксонметезис (не разрушить аксон), аксоны сохранят свою структурную целостность, но испытывают ухудшение функции в аксональных транспортных системах. Исследования показали, что даже низкое давление в 30 мм рт. ст. может нарушить аксональный транспорт. [4] [2]
Теория двойного сдавливания изначально относилась к антероградному аксональному транспорту. Например, спинальное компрессионное повреждение, как предполагалось, увеличивает восприимчивость к более дистальным компрессионным повреждениям, таким как запястный туннель. Существует дополнительная теория обратного двойного сдавливания, которая относится к ретроградному аксональному транспорту. [5]
Обширное образование рубцовой ткани является основной причиной ущемления нерва, а для глубокого ягодичного синдрома (ущемление седалищного нерва в глубоком ягодичном пространстве) это наиболее распространенная причина. [11] Хотя концепция рубцовой ткани, вызывающей травмы от растяжения, широко принята, [2] ее роль более сложна, чем строгое вызывание травм от растяжения. Сама рубцовая ткань очень плотная и способна оказывать давление на нерв через ленты (например, ремень безопасности) [24] или создавать фиброзный туннель, который способен защемлять нерв под давлением из-за своей прочности. [1] В запущенных случаях рубцовая ткань может быть обнаружена во всех слоях нерва, нарушая кровоток и основные функции различных типов тканей. [5] Это означает, что рубцовая ткань довольно устойчива в своей способности повреждать нервы. Она может делать это посредством растяжения (фиброваскулярные прикрепления), компрессии (остеофиброзные туннели) или может быть связана с воспалительной реакцией, которая повреждает ткань (фиброз).