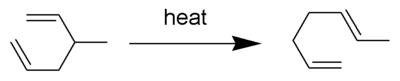
Перегруппировка Копа — это широко изученная органическая реакция , включающая [3,3]-сигматропную перегруппировку 1,5- диенов . [1] [2] [3] [4] Она была разработана Артуром С. Копом и Элизабет Харди . Например, 3-метил-гекса-1,5-диен, нагретый до 300 °C, дает гепта-1,5-диен.
Перегруппировка Коупа приводит к появлению флюкциональных состояний молекул в семействе буллваленов .
Перегруппировка Копа является прототипическим примером согласованной сигматропной перегруппировки. Она классифицируется как [3,3]-сигматропная перегруппировка с символом Вудворда–Хоффмана [ π 2 s + σ 2 s + π 2 s ] и, следовательно, термически разрешена. Иногда полезно думать о ней как о прохождении через переходное состояние, энергетически и структурно эквивалентное дирадикалу , хотя дирадикал обычно не является истинным промежуточным состоянием (минимум потенциальной энергии). [5] Проиллюстрированное здесь переходное состояние кресла является предпочтительным в системах с открытой цепью (как показали эксперименты Деринга-Рота). Однако конформационно ограниченные системы, такие как цис -1,2-дивинилциклопропаны, могут подвергаться перегруппировке в конформации лодки.
В настоящее время общепризнано, что большинство перегруппировок Копе следуют разрешенному согласованному маршруту через ароматическое переходное состояние Хюккеля и что дирадикальное промежуточное соединение не образуется. Однако согласованная реакция часто может быть асинхронной, и электронно-возмущенные системы могут иметь значительный дирадикальный характер в переходном состоянии. [6] Ниже представлена репрезентативная иллюстрация переходного состояния перегруппировки Копе электронно-нейтрального гекса-1,5-диена . Здесь можно увидеть, что две π-связи разрываются, в то время как образуются две новые π-связи, и одновременно разрывается σ-связь, в то время как образуется новая σ-связь. В отличие от перегруппировки Кляйзена , перегруппировки Копе без снятия напряжения или электронного возмущения часто близки к термически нейтральным и, следовательно, могут достигать лишь частичной конверсии из-за недостаточно благоприятной константы равновесия . В случае гекса-1,5-диена перегруппировка вырожденная (продукт идентичен исходному веществу), поэтому K = 1 по необходимости.
В асимметричных диенах часто необходимо учитывать стереохимию, которую в случае перициклических реакций, таких как перегруппировка Коупа, можно предсказать с помощью правил Вудворда–Хоффмана и учета предпочтительности геометрии переходного состояния кресла.
Перегруппировка широко используется в органическом синтезе. Она является симметрией -разрешенной, когда она супрафациальна для всех компонентов. Переходное состояние молекулы проходит через переходное состояние типа лодки или кресла. Примером перегруппировки Коупа является расширение циклобутанового кольца до циклоокта-1,5-диенового кольца:

В этом случае реакция должна пройти через переходное состояние ванны , чтобы образовались две цис- двойные связи . Транс-двойная связь в кольце была бы слишком напряженной . Реакция происходит в термических условиях. Движущей силой реакции является потеря напряжения циклобутанового кольца.
Органокаталитическая перегруппировка Копе была впервые описана в 2016 году. В этом процессе используется альдегидзамещенный 1,5-диен, что позволяет достичь «иминиевого катализа» с использованием гидразидного катализатора и достичь умеренных уровней энантиоселективности (до 47% ее). [7]
Ряд ферментов катализируют перегруппировку Коупа, хотя в природе ее возникновение встречается редко. [8] [9]
В перегруппировке окси-Коупа гидроксильная группа присоединяется к С3 , образуя еналь или енон после кето-енольной таутомерии промежуточного енола. [10] [11] [12]

В своей первоначальной реализации реакция окси-Коупа требовала высоких температур. Последующие работы показали, что соответствующие алкоксиды калия перестраивались быстрее на 10 10 до 10 17 . [13] Благодаря этому нововведению реакция хорошо протекает при комнатной температуре или даже при 0 °C. Обычно для получения диссоциированного алкоксида калия используются гидрид калия и 18-краун-6 : [14]

Диастереомер исходного материала , показанного выше с экваториальной винильной группой, не реагирует, что свидетельствует о согласованной природе этой реакции. Тем не менее, переходное состояние реакции, как полагают, имеет высокую степень бирадикального характера. Следовательно, анион-ускоренная окси-Cope реакция может протекать с высокой эффективностью даже в системах, которые не допускают эффективного орбитального перекрытия , как показано на ключевом этапе синтеза перипланона B : [15]
![Пример из [Стюарт Шрайбер]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5a/Schreiber.png/600px-Schreiber.png)
Соответствующие нейтральные окси-копе- и силокси-копе-перегруппировки не дали результатов, приведя только к продуктам элиминирования при 200 °C.
Другой разновидностью перегруппировки Копе являются аза-перегруппировки Копе .