Полиовирус , возбудитель полиомиелита (также известного как полиомиелит), представляет собой серотип вида Enterovirus C семейства Picornaviridae . [1] Существует три серотипа полиовируса: типы 1, 2 и 3.
Полиовирус состоит из генома РНК и белкового капсида . Геном представляет собой геном одноцепочечной положительной смысловой РНК (+оцРНК) длиной около 7500 нуклеотидов . [2] Вирусная частица имеет диаметр около 30 нм и имеет икосаэдрическую симметрию . Из-за короткого генома и простого состава — только РНК и инкапсулирующей его икосаэдрической белковой оболочки — полиовирус широко считается простейшим значимым вирусом. [3]
Полиовирус был впервые выделен в 1909 году Карлом Ландштейнером и Эрвином Поппером . [4] Структура вируса была впервые выяснена в 1958 году с помощью дифракции рентгеновских лучей командой Биркбек-колледжа под руководством Розалинды Франклин , [5] [6] показав, что вирус полиомиелита имеет икосаэдрическую симметрию. [7]
В 1981 году геном полиовируса был опубликован двумя разными группами исследователей: Винсентом Раканьелло и Дэвидом Балтимором из Массачусетского технологического института [8] и Наоми Китамурой и Эккардом Уиммером из Университета Стоуни-Брук . [9]
Трехмерная структура полиовируса была определена в 1985 году Джеймсом Хоглом из Научно-исследовательского института Скриппса с использованием рентгеновской кристаллографии. [10]
Полиовирус является одним из наиболее хорошо изученных вирусов и стал полезной модельной системой для понимания биологии РНК-вирусов .
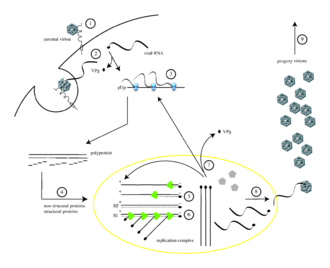
Полиовирус инфицирует клетки человека путем связывания с иммуноглобулиноподобным рецептором CD155 (также известным как рецептор полиовируса или PVR) [12] [13] на поверхности клетки. [14] Взаимодействие полиовируса и CD155 способствует необратимому конформационному изменению вирусной частицы, необходимому для проникновения вируса. [15] [16] Считалось , что после прикрепления к мембране клетки- хозяина проникновение вирусной нуклеиновой кислоты происходит одним из двух способов: через образование поры в плазматической мембране, через которую РНК затем «вводится» в клеточную мембрану. цитоплазме клетки-хозяина или путем захвата вируса путем рецептор-опосредованного эндоцитоза . [17] Недавние экспериментальные данные подтверждают последнюю гипотезу и предполагают, что полиовирус связывается с CD155 и поглощается эндоцитозом. Сразу после интернализации частицы вирусная РНК высвобождается. [18]
Полиовирус представляет собой вирус с положительной цепью РНК . Таким образом, геном, заключенный внутри вирусной частицы, может использоваться в качестве информационной РНК и немедленно транслироваться клеткой-хозяином. При проникновении вирус захватывает механизм трансляции клетки, вызывая ингибирование синтеза клеточного белка в пользу производства вирус-специфического белка. [19] В отличие от мРНК клетки-хозяина, 5'-конец РНК полиовируса чрезвычайно длинный — более 700 нуклеотидов — и хорошо структурирован. Эта область вирусного генома называется внутренним местом входа рибосомы (IRES). Эта область состоит из множества вторичных структур и 3 или 4 доменов. Домен 3 представляет собой самосворачивающийся элемент РНК, который содержит консервативные структурные мотивы в различных стабильных петлях стебля, связанных двумя четырехсторонними соединениями. Поскольку IRES состоит из множества доменов, сами эти домены состоят из множества петель, которые способствуют модифицированной трансляции без 5'-конца путем захвата рибосом. Петля взаимодействия домена 3 известна как тетрапетля GNRA. Остатки аденозинов А180 и А181 в тетрапетле ГУАА образуют водородные связи посредством неканонических спаривающих взаимодействий с парами оснований рецепторов C230/G242 и G231/C241 соответственно. [20] Генетические мутации в этой области предотвращают выработку вирусного белка. [21] [22] [23] Первый обнаруженный IRES был обнаружен в РНК полиовируса. [24]
мРНК полиовируса транслируется как один длинный полипептид . Этот полипептид затем автоматически расщепляется внутренними протеазами примерно на 10 отдельных вирусных белков. Не все расщепления происходят с одинаковой эффективностью. Следовательно, количества белков, образующихся при расщеплении полипептида, различаются: например, образуется меньшее количество 3D pol , чем количество капсидных белков VP1–4. [25] [26] Этими отдельными вирусными белками являются: [3] [27]

После трансляции, транскрипции и репликации генома, которые происходят в одном процессе, реализуется синтез (+)РНК). Для репликации инфицирующей (+) РНК необходимо транскрибировать несколько копий (-) РНК, а затем использовать их в качестве матриц для синтеза (+) РНК. Репликативные промежуточные соединения (РИ), представляющие собой ассоциацию молекул РНК, состоящую из матричной РНК и нескольких растущих РНК различной длины, наблюдаются как в комплексах репликации (-)РНК, так и (+)РНК. Для синтеза РНК каждой отрицательной и положительной цепи белок VPg в полиовирусе действует как праймер. РНК-зависимая РНК-полимераза полиовируса добавляет два урациловых нуклеотида (UU) к белку VPg, используя поли(А)-хвост на 3'-конце +оцРНК генома в качестве образца для синтеза антигеномной РНК с отрицательной цепью. Чтобы инициировать синтез -оцРНК, необходим тирозингидроксил VPg. Но для инициации синтеза РНК положительной цепи необходимо CRE-зависимое уридилилирование VPg. Это означает, что VPg снова используется в качестве праймера, однако на этот раз он добавляет два уридинтрифосфата, используя цис-действующий элемент репликации (CRE) в качестве матрицы. [29] [30]
CRE полиовируса идентифицирован как недостигнутый стебель с парными основаниями и конечная петля, состоящая из 61 нуклеотида. CRE обнаружен в энтеровирусах. Это хорошо сохранившийся вторичный структурный элемент РНК, расположенный в кодирующей полипротеин области генома. Комплекс может быть транслоцирован в 5'-область генома, не обладающую кодирующей активностью, на расстоянии не менее 3,7 т.п.н. от исходного местоположения. Этот процесс может происходить без негативного влияния на деятельность. Копии CRE не оказывают негативного влияния на репликацию. Процесс уридилилирования VPg, который происходит в CRE, требует присутствия 3CD pro , который является РНК-связывающим белком. Он привязан к CRE напрямую и конкретно. Благодаря его присутствию VPg может правильно связывать CRE, и первичное производство протекает без проблем. [31]
Некоторые из (+) молекул РНК используются в качестве матриц для дальнейшего (-) синтеза РНК, некоторые функционируют как мРНК, а некоторым суждено стать геномами вирионов-потомков. [25]
При сборке новых вирусных частиц (т.е. упаковке генома потомства в прокапсид, который может выжить вне клетки-хозяина), включая, соответственно: [32]
Полностью собранный полиовирус покидает пределы клетки-хозяина путем лизиса [33] через 4–6 часов после начала инфекции в культивируемых клетках млекопитающих. [34] Механизм высвобождения вируса из клетки неясен, [2] но каждая умирающая клетка может высвободить до 10 000 полиовирионов . [34]
Дрейк продемонстрировал, что полиовирус способен подвергаться реактивации множественности. [35] То есть, когда полиовирусы облучались УФ-светом и подвергались множественным инфекциям клеток-хозяев, жизнеспособное потомство могло образовываться даже при дозах УФ-излучения, которые инактивировали вирус при единичных инфекциях. Полиовирус может подвергаться генетической рекомбинации , если в одной и той же клетке-хозяине присутствуют по крайней мере два вирусных генома . Киркегаард и Балтимор [36] представили доказательства того, что РНК-зависимая РНК-полимераза (RdRP) катализирует рекомбинацию с помощью механизма выбора копии, при котором RdRP переключается между матрицами (+)ssRNA во время синтеза отрицательной цепи. Рекомбинация РНК-вирусов, по-видимому, является адаптивным механизмом восстановления повреждений генома. [37] [38]
Полиовирус структурно похож на другие энтеровирусы человека ( вирусы Коксаки , эховирусы и риновирусы ), которые также используют иммуноглобулиноподобные молекулы для распознавания и проникновения в клетки-хозяева. [13] Филогенетический анализ последовательностей РНК и белков полиовируса позволяет предположить, что он, возможно, произошел от предка вируса Коксаки А С-кластера , который возник в результате мутации внутри капсида. [39] Особое видообразование полиовируса, вероятно, произошло в результате изменения специфичности клеточного рецептора с молекулы межклеточной адгезии-1 (ICAM-1), используемой C-кластерными вирусами Коксаки А, на CD155 ; что приводит к изменению патогенности и позволяет вирусу инфицировать нервную ткань.
Частота мутаций в вирусе относительно высока даже для РНК-вируса со скоростью синонимических замен 1,0 x 10 -2 замен/сайт/год и скоростью несинонимичных замен 3,0 x 10 -4 замен/сайт/год. [40] Распределение оснований внутри генома не является случайным: аденозин встречается реже, чем ожидалось, на 5'-конце и выше на 3'-конце. [41] Использование кодонов не является случайным: предпочтение отдается кодонам, оканчивающимся на аденозин, а кодонам, оканчивающимся на цитозин или гуанин , следует избегать. Использование кодонов различается между тремя генотипами и, по-видимому, обусловлено мутацией, а не отбором. [42]
Каждый из трех серотипов полиовируса: PV-1, PV-2 и PV-3 имеет несколько отличающийся капсидный белок. Капсидные белки определяют специфичность клеточных рецепторов и антигенность вируса. ПВ-1 — наиболее распространенная форма, встречающаяся в природе, но все три формы чрезвычайно заразны . [4] По состоянию на март 2020 года дикий PV-1 широко локализован в регионах Пакистана и Афганистана. Сертификация ликвидации местной передачи произошла в сентябре 2015 года для дикого PV-2, после последнего обнаружения в 1999 году, [43] и в октябре 2019 года для дикого PV-3, после последнего обнаружения в 2012 году. [44]
Специфические штаммы каждого серотипа используются для приготовления вакцин против полиомиелита . Неактивную полиомиелитную вакцину готовят путем инактивации формалином трех диких вирулентных эталонных штаммов: Махони или Брундерса (PV-1), MEF-1/Lansing (PV-2) и Saukett/Leon (PV-3). Оральная полиомиелитная вакцина содержит живые аттенуированные (ослабленные) штаммы трех серотипов полиовируса. Передача штаммов вируса в эпителиальные клетки почек обезьян приводит к мутациям вирусного IRES и препятствует (или ослабляет) способность вируса инфицировать нервную ткань. [34]
Полиовирусы ранее классифицировались как отдельный вид, принадлежащий к роду Enterovirus семейства Picornaviridae . В 2008 году вид полиовируса был исключен, и три серотипа были отнесены к виду энтеровируса человека C (позже переименованного в Enterovirus C ) из рода Enterovirus семейства Picornaviridae . Типовой вид рода Enterovirus был изменен с полиовируса на (человеческий) энтеровирус C. [45]
Основным фактором, определяющим инфекцию любого вируса, является его способность проникать в клетку и производить дополнительные инфекционные частицы. Считается, что наличие CD155 определяет животных и ткани, которые могут быть инфицированы полиовирусом. CD155 обнаружен (вне лабораторий) только на клетках человека, высших приматов и обезьян Старого Света . Полиовирус, однако, является исключительно человеческим патогеном и в природе не заражает другие виды (хотя шимпанзе и обезьяны Старого Света могут быть заражены экспериментально). [46]
Ген CD155 , по-видимому, подвергся положительному отбору . [47] Белок имеет несколько доменов, из которых домен D1 содержит сайт связывания вируса полиомиелита. Внутри этого домена за связывание вируса отвечают 37 аминокислот.
Полиовирус – это энтеровирус . Заражение происходит фекально-оральным путем , то есть человек заглатывает вирус, и репликация вируса происходит в желудочно-кишечном тракте . [48] Вирус выделяется с фекалиями инфицированных людей. В 95% случаев наблюдается лишь первичное, преходящее наличие виремии (вируса в кровотоке), а полиовирусная инфекция протекает бессимптомно . Примерно в 5% случаев вирус распространяется и размножается в других местах, таких как бурый жир , ретикулоэндотелиальная ткань и мышцы . Устойчивая репликация вируса вызывает вторичную виремию и приводит к развитию незначительных симптомов, таких как лихорадка, головная боль и боль в горле. [49] Паралитический полиомиелит встречается менее чем в 1% случаев полиовирусной инфекции. Паралитическое заболевание возникает, когда вирус проникает в центральную нервную систему (ЦНС) и размножается в двигательных нейронах спинного мозга , ствола головного мозга или двигательной коры , что приводит к избирательному разрушению двигательных нейронов, приводящему к временному или постоянному параличу . Это очень редкое явление у младенцев, у которых еще есть антитела к полиовирусу , полученные от их матерей. [50] В редких случаях паралитический полиомиелит приводит к остановке дыхания и смерти. При паралитическом заболевании часто наблюдаются мышечные боли и спазмы, предшествующие появлению слабости и паралича. Паралич обычно сохраняется от нескольких дней до недель до выздоровления. [51]
Во многих отношениях неврологическая фаза инфекции считается случайным отклонением от нормальной желудочно-кишечной инфекции. [17] Механизмы проникновения полиовируса в ЦНС изучены недостаточно. Для объяснения его появления были предложены три не взаимоисключающие гипотезы. Все теории требуют первичной виремии. Первая гипотеза предсказывает, что вирионы переходят непосредственно из крови в центральную нервную систему, преодолевая гематоэнцефалический барьер независимо от CD155. [52] Вторая гипотеза предполагает, что вирионы транспортируются из периферических тканей, омываемых виремической кровью, например мышечной ткани, в спинной мозг по нервным путям посредством ретроградного аксонального транспорта . [53] [54] [55] Третья гипотеза заключается в том, что вирус импортируется в ЦНС через инфицированные моноциты или макрофаги . [11]
Полиомиелит – заболевание центральной нервной системы. Однако считается, что CD155 присутствует на поверхности большинства или всех клеток человека. Следовательно, экспрессия рецептора не объясняет, почему полиовирус преимущественно инфицирует определенные ткани. Это позволяет предположить, что тропизм тканей определяется после клеточного инфицирования. Недавние исследования показали, что реакция интерферона I типа (в частности, реакция интерферона альфа и бета) является важным фактором, определяющим, какие типы клеток поддерживают репликацию полиовируса. [56] У мышей, экспрессирующих CD155 (посредством генной инженерии), но не имеющих рецептора интерферона I типа, полиовирус не только реплицируется в расширенном репертуаре типов тканей, но и эти мыши также способны заражаться вирусом перорально. [57]
Полиовирус использует два ключевых механизма для обхода иммунной системы . Во-первых, он может пережить очень кислую среду желудка, позволяя вирусу заразить хозяина и распространиться по всему организму через лимфатическую систему . [3] Во-вторых, поскольку он может очень быстро размножаться, вирус поражает органы хозяина до того, как может возникнуть иммунный ответ. [58] Если подробности указаны на этапе прикрепления; полиовирус с каньонами на поверхности вириона имеет места прикрепления вируса, расположенные в карманах у основания каньонов. Каньоны слишком узки для доступа антител , поэтому места прикрепления вируса защищены от иммунного надзора хозяина, в то время как остальная часть поверхности вириона может мутировать, чтобы избежать иммунного ответа хозяина. [59]
У людей, подвергшихся воздействию полиовируса либо в результате инфекции, либо в результате иммунизации полиовакциной , развивается иммунитет . У иммунных лиц антитела против полиовируса присутствуют в миндалинах и желудочно-кишечном тракте (в частности, антитела IgA ) и способны блокировать репликацию полиовируса; Антитела IgG и IgM против полиовируса могут предотвратить распространение вируса на мотонейроны центральной нервной системы. [34] Заражение одним серотипом полиовируса не обеспечивает иммунитета против других серотипов; однако повторные приступы у одного и того же человека случаются крайне редко. [60]
Хотя люди являются единственными известными естественными хозяевами полиовируса, обезьяны могут быть заражены экспериментально, и их уже давно используют для изучения полиовируса. В 1990–1991 годах в двух лабораториях была разработана модель полиомиелита на мелких животных. Мыши были созданы для экспрессии человеческого рецептора к полиовирусу (hPVR). [61] [62]
В отличие от нормальных мышей, мыши с трансгенным рецептором полиовируса (TgPVR) восприимчивы к полиовирусу, который вводится внутривенно или внутримышечно , а также при введении непосредственно в спинной или головной мозг . [63] При заражении у мышей TgPVR наблюдаются признаки паралича, напоминающие симптомы полиомиелита у людей и обезьян, а центральная нервная система парализованных мышей гистоцитохимически подобна таковой у людей и обезьян. Эта мышиная модель полиовирусной инфекции человека оказалась бесценным инструментом для понимания биологии и патогенности полиовируса. [64]
Три различных типа мышей TgPVR хорошо изучены: [65]
Недавно была разработана четвертая модель мыши TgPVR. Эти мыши «cPVR» несут кДНК hPVR , управляемую промотором β- актина , и оказались восприимчивыми к полиовирусу внутримозговым, внутримышечным и интраназальным путями. Кроме того, у этих мышей после интраназальной инокуляции возможно развитие бульбарной формы полиомиелита . [66]
Развитие мышей TgPVR оказало глубокое влияние на производство оральной полиовирусной вакцины (ОПВ). Раньше контроль безопасности ОПВ приходилось проводить с использованием обезьян, поскольку к вирусу восприимчивы только приматы. В 1999 году Всемирная организация здравоохранения одобрила использование мышей TgPVR в качестве альтернативного метода оценки эффективности вакцины против полиовируса типа 3. В 2000 году модель на мышах была одобрена для испытаний вакцин против полиовируса типа 1 и типа 2. [67]

В 1981 году Раканиелло и Балтимор использовали технологию рекомбинантной ДНК для создания первого инфекционного клона РНК-вируса животного, полиовируса. ДНК, кодирующая РНК-геном полиовируса, была введена в культивируемые клетки млекопитающих и получен инфекционный полиовирус. [68] Создание инфекционного клона продвинуло понимание биологии полиовируса и стало стандартной технологией, используемой для изучения многих других вирусов.
В 2002 году группе Экарда Уиммера из Университета Стоуни-Брук удалось синтезировать полиовирус на основе его химического кода, создав первый в мире синтетический вирус. [69] Ученые сначала преобразовали опубликованную последовательность РНК полиовируса длиной 7741 основание в последовательность ДНК, поскольку ДНК было легче синтезировать. Короткие фрагменты этой последовательности ДНК были получены по почте и собраны. Затем компания по синтезу генов собрала полный вирусный геном . В синтезированную ДНК были включены девятнадцать маркеров , чтобы ее можно было отличить от природного полиовируса. Ферменты использовались для преобразования ДНК обратно в РНК, ее естественное состояние. Затем были использованы другие ферменты для трансляции РНК в полипептид, производящий функциональные вирусные частицы. Весь этот кропотливый процесс занял два года. Недавно созданный синтетический вирус был введен трансгенным мышам PVR, чтобы определить, способна ли синтетическая версия вызывать заболевание. Синтетический вирус был способен реплицироваться, заражать и вызывать паралич или смерть мышей. Однако синтетическая версия была в 1000–10 000 раз слабее исходного вируса, вероятно, из-за одного из добавленных маркеров. [70]
Модификация полиовируса, названная PVSRIPO , была протестирована в ранних клинических испытаниях как возможное средство лечения рака. [71] [ нужно обновить ]