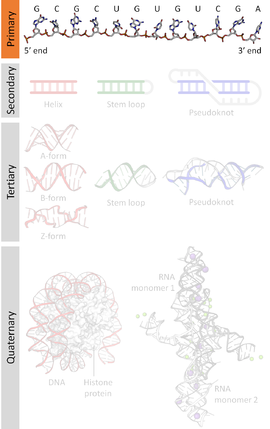

Последовательность нуклеиновой кислоты представляет собой последовательность оснований в нуклеотидах , образующих аллели внутри молекулы ДНК (с использованием GACT) или РНК (GACU). Эта последовательность обозначается серией из пяти разных букв, обозначающих порядок нуклеотидов. По соглашению последовательности обычно располагаются от 5'-конца к 3'-концу . Для ДНК с ее двойной спиралью существует два возможных направления обозначенной последовательности; из этих двух используется смысловая цепь . Поскольку нуклеиновые кислоты обычно представляют собой линейные (неразветвленные) полимеры , определение последовательности эквивалентно определению ковалентной структуры всей молекулы. По этой причине последовательность нуклеиновой кислоты также называют первичной структурой .
Последовательность представляет генетическую информацию . Биологическая дезоксирибонуклеиновая кислота представляет собой информацию , направляющую функции организма .
Нуклеиновые кислоты также имеют вторичную структуру и третичную структуру . Первичную структуру иногда ошибочно называют «первичной последовательностью». Однако параллельной концепции вторичной или третичной последовательности не существует.

Нуклеиновые кислоты состоят из цепочки связанных единиц, называемых нуклеотидами. Каждый нуклеотид состоит из трех субъединиц: фосфатная группа и сахар ( рибоза в случае РНК , дезоксирибоза в ДНК ) составляют основу цепи нуклеиновой кислоты, а к сахару присоединено одно из множества нуклеиновых оснований . Нуклеиновые основания играют важную роль в спаривании оснований нитей для формирования вторичных и третичных структур более высокого уровня, таких как знаменитая двойная спираль .
Возможные буквы: A , C , G и T , обозначающие четыре нуклеотидных основания цепи ДНК – аденин , цитозин , гуанин , тимин – ковалентно связанные с фосфодиэфирным остовом. В типичном случае последовательности печатаются примыкающими друг к другу без промежутков, как в последовательности AAAGTCTGAC, читаемой слева направо в направлении от 5’ к 3’ . Что касается транскрипции , последовательность находится в кодирующей цепи, если она имеет тот же порядок, что и транскрибируемая РНК.
Одна последовательность может быть комплементарна другой последовательности, что означает, что они имеют основания в каждой позиции в комплементарном (т. е. от A до T, от C до G) и в обратном порядке. Например, последовательность, комплементарная TTAC, представляет собой GTAA. Если одна цепь двухцепочечной ДНК считается смысловой цепью, то другая цепь, называемая антисмысловой цепью, будет иметь последовательность, комплементарную смысловой цепи.
Хотя A, T, C и G обозначают конкретный нуклеотид в определенной позиции, существуют также буквы, обозначающие неоднозначность, которые используются, когда в этой позиции может находиться более одного типа нуклеотидов. Правила Международного союза теоретической и прикладной химии ( IUPAC ) следующие: [1]
Например, W означает, что либо аденин, либо тимин могут находиться в этом положении без нарушения функциональности последовательности.
Эти символы также действительны для РНК, за исключением того, что U (урацил) заменяет Т (тимин). [1]
Помимо аденина (А), цитозина (С), гуанина (G), тимина (Т) и урацила (U), ДНК и РНК также содержат основания, которые были модифицированы после образования цепи нуклеиновой кислоты. В ДНК наиболее распространенным модифицированным основанием является 5-метилцитидин (m5C). В РНК имеется множество модифицированных оснований, в том числе псевдоуридин (Ψ), дигидроуридин (D), инозин (I), риботимидин (rT) и 7-метилгуанозин (m7G). [3] [4] Гипоксантин и ксантин — два из многих оснований, созданных в результате присутствия мутагена , причем оба они являются результатом дезаминирования (замены аминогруппы карбонильной группой). Гипоксантин производится из аденина , а ксантин — из гуанина . [5] Точно так же дезаминирование цитозина приводит к образованию урацила .
Учитывая две 10-нуклеотидные последовательности, выровняйте их и сравните различия между ними. Рассчитайте процентную разницу, разделив количество различий между основаниями ДНК на общее количество нуклеотидов. В этом случае имеется три различия в последовательности из 10 нуклеотидов. Таким образом, разница составляет 30%.
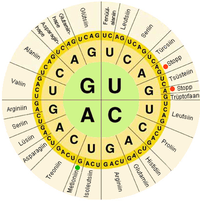
В биологических системах нуклеиновые кислоты содержат информацию, которая используется живой клеткой для построения специфических белков . Последовательность нуклеиновых оснований на цепи нуклеиновой кислоты транслируется клеточным механизмом в последовательность аминокислот, составляющих белковую цепь. Каждая группа из трех оснований, называемая кодоном , соответствует одной аминокислоте, и существует определенный генетический код , согласно которому каждая возможная комбинация трех оснований соответствует определенной аминокислоте.
Центральная догма молекулярной биологии описывает механизм, с помощью которого белки конструируются с использованием информации, содержащейся в нуклеиновых кислотах. ДНК транскрибируется в молекулы мРНК , которые попадают в рибосому , где мРНК используется в качестве матрицы для построения белковой цепи. Поскольку нуклеиновые кислоты могут связываться с молекулами с комплементарными последовательностями, существует различие между « смысловыми » последовательностями, кодирующими белки, и комплементарной «антисмысловой» последовательностью, которая сама по себе нефункциональна, но может связываться со смысловой цепью.
Секвенирование ДНК — это процесс определения нуклеотидной последовательности данного фрагмента ДНК . Последовательность ДНК живого существа кодирует необходимую информацию для выживания и размножения живого существа. Поэтому определение последовательности полезно в фундаментальных исследованиях того, почему и как живут организмы, а также в прикладных предметах. Из-за важности ДНК для живых существ знание последовательности ДНК может быть полезно практически в любом биологическом исследовании . Например, в медицине его можно использовать для выявления, диагностики и потенциальной разработки методов лечения генетических заболеваний . Аналогичным образом, исследования патогенов могут привести к разработке методов лечения инфекционных заболеваний. Биотехнология – это развивающаяся дисциплина, имеющая потенциал для создания множества полезных продуктов и услуг.
РНК не секвенируется напрямую. Вместо этого она копируется в ДНК с помощью обратной транскриптазы , и эта ДНК затем секвенируется.
Современные методы секвенирования основаны на дискриминационной способности ДНК-полимераз и, следовательно, могут различать только четыре основания. Инозин (созданный из аденозина при редактировании РНК ) читается как G, а 5-метилцитозин (созданный из цитозина путем метилирования ДНК ) читается как C. При нынешних технологиях сложно секвенировать небольшие количества ДНК. поскольку сигнал слишком слаб для измерения. Эту проблему можно преодолеть с помощью амплификации полимеразной цепной реакции (ПЦР).

После того как последовательность нуклеиновой кислоты получена из организма, она сохраняется в silico в цифровом формате. Цифровые генетические последовательности могут храниться в базах данных последовательностей , анализироваться (см. «Анализ последовательностей» ниже), изменяться в цифровом виде и использоваться в качестве шаблонов для создания новой фактической ДНК с использованием искусственного синтеза генов .
Цифровые генетические последовательности можно анализировать с помощью инструментов биоинформатики, чтобы попытаться определить их функцию.
ДНК в геноме организма можно анализировать для диагностики уязвимости к наследственным заболеваниям , а также использовать для определения отцовства ребенка (генетического отца) или происхождения человека . Обычно каждый человек несет в себе две вариации каждого гена : одну от матери, другую от отца. Считается, что геном человека содержит около 20 000–25 000 генов. Помимо изучения хромосом до уровня отдельных генов, генетическое тестирование в более широком смысле включает в себя биохимические тесты на возможное наличие генетических заболеваний или мутантных форм генов, связанных с повышенным риском развития генетических нарушений.
Генетическое тестирование выявляет изменения в хромосомах, генах или белках. [6] Обычно тестирование используется для выявления изменений, связанных с наследственными заболеваниями. Результаты генетического теста могут подтвердить или исключить предполагаемое генетическое заболевание или помочь определить вероятность развития или передачи генетического заболевания у человека. В настоящее время используется несколько сотен генетических тестов, и еще больше разрабатывается. [7] [8]
В биоинформатике выравнивание последовательностей — это способ упорядочения последовательностей ДНК , РНК или белка для выявления областей сходства, которое может быть связано с функциональными, структурными или эволюционными отношениями между последовательностями. [9] Если две последовательности в выравнивании имеют общего предка, несовпадения можно интерпретировать как точечные мутации , а пробелы — как мутации вставки или делеции ( индели ), возникшие в одной или обеих линиях с момента их расхождения друг от друга. При выравнивании последовательностей белков степень сходства между аминокислотами, занимающими определенное положение в последовательности, можно интерпретировать как грубую меру того, насколько консервативен конкретный участок или мотив последовательности среди линий. Отсутствие замен или наличие только очень консервативных замен (то есть замены аминокислот, боковые цепи которых имеют сходные биохимические свойства) в определенном участке последовательности позволяют предположить [10] , что этот участок имеет структурное или функциональное значение. . Хотя нуклеотидные основания ДНК и РНК более похожи друг на друга, чем аминокислоты, консервативность пар оснований может указывать на схожую функциональную или структурную роль. [11]
Вычислительная филогенетика широко использует выравнивание последовательностей при построении и интерпретации филогенетических деревьев , которые используются для классификации эволюционных отношений между гомологичными генами, представленными в геномах дивергентных видов. Степень различия последовательностей в наборе запросов качественно связана с эволюционным расстоянием последовательностей друг от друга. Грубо говоря, высокая идентичность последовательностей предполагает, что рассматриваемые последовательности имеют сравнительно молодого самого недавнего общего предка , тогда как низкая идентичность предполагает, что расхождение более древнее. Это приближение, которое отражает гипотезу « молекулярных часов », согласно которой примерно постоянная скорость эволюционных изменений может быть использована для экстраполяции времени, прошедшего с тех пор, как два гена впервые разошлись (то есть время слияния ), предполагает , что эффекты мутации и отбора константа во всех линиях последовательности. Следовательно, он не учитывает возможные различия между организмами или видами в скорости репарации ДНК или возможную функциональную консервативность определенных участков последовательности. (В случае нуклеотидных последовательностей гипотеза молекулярных часов в своей самой базовой форме также не учитывает разницу в скорости принятия между « молчащими» мутациями , которые не меняют значения данного кодона , и другими мутациями, которые приводят к включению в структуру другой аминокислоты). белок.) Более статистически точные методы позволяют варьировать скорость эволюции на каждой ветви филогенетического дерева, что позволяет лучше оценить время слияния генов.
Часто первичная структура кодирует мотивы, имеющие функциональное значение. Некоторыми примерами мотивов последовательностей являются: блоки C/D [12] и H/ACA [13] мякРНК , сайт связывания Sm, обнаруженный в сплайсосомных РНК , таких как U1 , U2 , U4 , U5 , U6 , U12 и U3 , Shine -последовательность Дальгарно , [14] консенсусная последовательность Козака [15] и терминатор РНК-полимеразы III . [16]
В биоинформатике энтропия последовательности, также известная как сложность последовательности или информационный профиль, [17] представляет собой числовую последовательность, обеспечивающую количественную меру локальной сложности последовательности ДНК независимо от направления обработки. Манипуляции с информационными профилями позволяют анализировать последовательности с использованием методов без выравнивания, таких как, например, обнаружение мотивов и перегруппировок. [17] [18] [19]